

| A. | 白色沉淀甲是Al(OH)3,气体甲是CO2,原混合物中一定含有Al3+和HCO3- | |
| B. | 白色沉淀乙是BaSO4,原混合物中一定含有SO42- | |
| C. | 气体乙一定是NO和NO2的混合气体 | |
| D. | 原混合物中一定含有Na+、Al3+、NO3-、SO32- |
分析 由焰色反应为黄色可知,一定含Na+,不能确定是否含K+;红棕色气体一定含二氧化氮,则一定含NO3-和SO32-,二者发生氧化还原反应,溶液甲与盐酸发生氧化还原反应,溶液乙中含SO42-,白色沉淀乙为硫酸钡;白色粉末加水,Al3+可分别与CO32-、HCO3-、SO32-等发生相互促进水解反应生成沉淀和气体,气体甲为二氧化碳或二氧化硫,沉淀甲一定为氢氧化铝,以此来解答.
解答 解:由焰色反应为黄色可知,一定含Na+,不能确定是否含K+;红棕色气体一定含二氧化氮,则一定含NO3-和SO32-,二者发生氧化还原反应,溶液甲与盐酸发生氧化还原反应,溶液乙中含SO42-,白色沉淀乙为硫酸钡;白色粉末加水,Al3+可分别与CO32-、HCO3-、SO32-等发生相互促进水解反应生成沉淀和气体,气体甲为二氧化碳或二氧化硫,沉淀甲一定为氢氧化铝,
A.可能为Al3+、CO32-的相互促进水解反应,生成沉淀和气体,故A错误;
B.SO42-可能是SO32-在酸性溶液中被NO2-氧化生成,则白色沉淀乙是BaSO4,所以原混合物可能含有SO42-,故B错误;
C.红棕色气体一定含二氧化氮,可能含二氧化碳或二氧化硫,故C错误;
D.由上述分析可知,白色粉末中一定含有Na+、Al3+、NO3-、SO32-,故D正确;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握流程中的现象、发生的反应及现象与结论的关系为解答的关键,侧重分析能力与推断能力的综合考查,题目难度较大.


科目:高中化学 来源: 题型:填空题
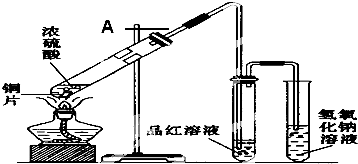
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (对苯醌)═N2H4+
(对苯醌)═N2H4+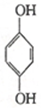 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为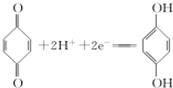 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 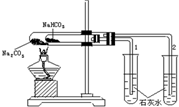 用如图装置比较Na2CO3与NaHCO3的稳定性 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. | 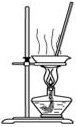 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 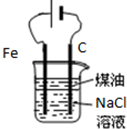 用如图装置制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com