
【题目】已,知:R-C≡C-H+R'Br ![]() R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式
R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 和苯乙炔互为同系物
和苯乙炔互为同系物
B. 炔烃和卤代烃在一定条件下可发生取代反应
C. 高分子材料P不能使溴的四氯化碳溶液褪色
D. 生成P的单体是![]() 和CH3Br
和CH3Br
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应的平均速率为0.6 mol (L s)-1
B.2 s时物质B的浓度为1.4 mol L-1
C.2 s时物质A的转化率为70%
D.2 s时物质A的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2在工业上具有广泛的用途,例如用作干电池去极剂、合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用________。
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是_______。

若用B装置制备少量的NH3,则a中盛放的药品是_______。
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式___________。
(2)观察步骤②所得滤液的颜色为_______,初步判定有单质I2生成。
(3)萃取滤液中的碘单质所用的仪器名称为_______,选择的萃取剂是______。
(4)步骤④静置后,观察到的现象是_______。
(5)简述分液的操作:________。
(6)步骤⑥中组装蒸馏装置还缺少的仪器是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质存在如下图所示的转化关系(反应条件、部分产物未标出),已知某物质X是一种正盐,E是强酸
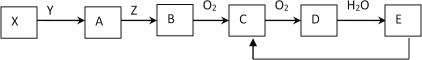
试回答下列问题:
(1)若Y为强酸,且B为黄色固体单质
①从组成物质的元素化合价变化角度预测C可能具有的性质_______________
②一定条件下E转化为C有多种途径,写出其中一种转化的化学反应方程式_______________________。
(2) 若Y为强碱,且B为空气中含量最高的气态单质
①写出实验室制取A的化学方程式______________________________________。
②若A→B的转化常用来检验Z气体管道的是否漏气,用该方法检验的现象是____________________,
其化学反应方程式_________________________________________。
③C、D都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应
C.形成光化学烟雾 D.引起水体富营养化
④将x mL C、y mL D混合于同一试管中,将试管倒置于水中,同时通入z mL O2充分反应后,试管内气体全部消失,则x:y:z不可能是 _______________
A 1:1:1 B 2:1:1
C 3:7:4 D 1:5:2
(3)无论Y为强酸或强碱均符合上述转化,则物质X的化学式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向 方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态。
(2)乙二酸俗名草酸,易溶于水,水溶液可以用酸性KMnO4溶液进行滴定;
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
某学习小组的同学设计了如下实验方法测定草酸晶体(H2C2O4·xH2O)中x值。
主要步骤如下:
A.称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
B.取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
C.用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL。
①滴定时,KMnO4标准溶液应装在 式滴定管中。
②本实验滴定达到终点的标志是 。
③通过上述数据,求得x= 。讨论:若滴定终点时俯视滴定管刻度,
则由此测得的x值会 。(填“偏大”、“偏小”、或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
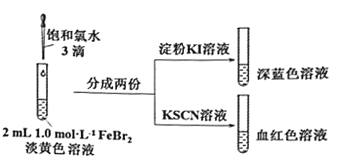
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
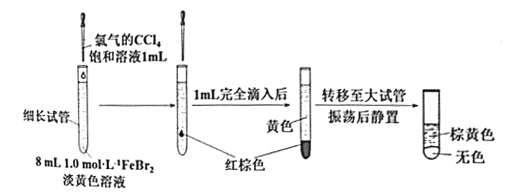
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 苯和甲苯分子中所有原子均在同一平面上
B. 苯不可以使KMnO4酸性溶液褪色而甲苯可以
C. 苯和甲苯都能与卤素单质、硝酸等发生取代反应
D. 苯的同系物的分子通式是CnH2n-6(n≥7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com