
下列事实不能用金属活动性解释的是
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C .工业上常用热还原法冶炼铁,用电解法冶炼钠
.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3。方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入________(一种过量的气体),该反应的离子方程式_______________________________________________。
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为_________。
(4)我国首创以铝、空气、海水为能源的新型电池。该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。这种海水电池的能量比“干电池”高20~50倍。该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光。该电池的总反应为:4Al+3O2+6H2O===4Al(OH)3。其负极材料为________,正极反应式为_________________。
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n)是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果。为确定碱式氯化铝分子式中的n值,可采用沉淀称量法。准确称取碱式氯化铝样品4.97 g,配制成500 mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液。然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35 g。 该碱式氯化铝中的n=________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A.B元素处于元素周期表中第三周期ⅥA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、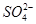
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、
C.水电离产生的c(H+)=10-13mol·L-1的溶液中:Na+、Cl-、 、
、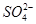
D.0.1 mol·L-1HNO3溶液中:Mg2+、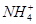 、Fe2+、Cl-
、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:简答题
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。

(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。

(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。

请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
常温下,浓度均为0.1 m ol/L 的下列四种盐溶液,其pH测定如下表所示:
ol/L 的下列四种盐溶液,其pH测定如下表所示:
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
维生素A1、B2的结构简式分别如图所示:
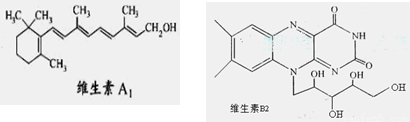
已知:
下列说法正确的是
A.1mol维生素A1最多与溴水中的4molBr2发生加成反应
B.维生素A1的分子式为C19H30O,是一种易溶于水的高分子。
C.维生素B2在酸性条件下彻底水解后得到的有机物,其分子内发生酯化得多种酯
D.用-C4H9取代维生素B2苯环上的一个H原子,最多可得4种同分异构体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
如图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。

(1)写出X的电子式:________________ ;E中含有的化学键类型是________________。
(2)Z与C以物质的量之比3?1反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
【物质结构与性质】
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素
组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的
二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为______,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个σ键, 个π键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com