
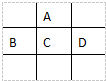
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: .
.分析 A、B、C、D、E五种短周期元素,根据元素周期表知,这四种元素处于第二、三周期,设C的原子序数是X,则A、B、D的原子序数分别是(X-8)、(X-1)、(X+1),相邻的A、B、C、D四种元素原子核外共有56个电子,
则(X-8)+(X-1)+X+(X+1)=56,则X=16,所以C是S元素,A是O元素,B是P元素,D是Cl元素,E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,则一个E原子失去3个电子生成阳离子,E的阳离子与A的阴离子核外电子层结构完全相同,则E是Al元素,以此解答该题.
解答 解:A、B、C、D、E五种短周期元素,根据元素周期表知,这四种元素处于第二、三周期,设C的原子序数是X,则A、B、D的原子序数分别是(X-8)、(X-1)、(X+1),相邻的A、B、C、D四种元素原子核外共有56个电子,
则(X-8)+(X-1)+X+(X+1)=56,则X=16,所以C是S元素,A是O元素,B是P元素,D是Cl元素,E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,则一个E原子失去3个电子生成阳离子,E的阳离子与A的阴离子核外电子层结构完全相同,则E是Al元素.
(1)由上述分析,可知A为氧、E为铝,故答案为:氧;铝;
(2)E是Al元素,位于周期表第三周期ⅢA族,故答案为:第三周期ⅢA族;
(3)D是Cl元素,HCl的电子式为 ,故答案为:
,故答案为: ;
;
(4)C是S元素,最高价氧化物水化物的化学式为H2SO4,故答案为:H2SO4;
(5)E是Al元素,最高价氧化物水化物为氢氧化铝,为两性氢氧化物,C是S元素,对应的最高价氧化物水化物为硫酸,二者反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:两;Al(OH)3+3H+=Al3++3H2O;
(6)同主族元素从上到下,元素的非金属性逐渐减弱,则O>S,同周期元素从左到右元素的非金属性逐渐减弱,则S>P,A、B、C的非金属性由强到弱顺序为O>S>P,即A>C>B,故答案为:A>C>B.
点评 本题考查元素周期表和元素周期律,为高考常见题型和高频考点,侧重于学生的分析能力的考查,元素的推断是解答本题的关键,注意理解掌握同主族元素原子序数关系,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
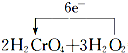 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
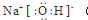 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性KMnO4溶液褪色.因此苯不能发生氧化反应 | |
| B. | 1mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| C. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| D. | 戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片可防止暴沸 | |
| C. | 加热饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com