
分析 (1)利用盖斯定律,1式加2式的二倍即可得到该方程式及焓变;
(2)根据反应速率v=$\frac{△c}{△t}$,结合物质表示的反应速率之比等于物质前边的系数之比来计算;
(3)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
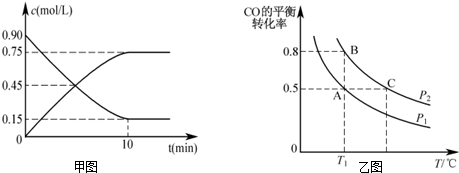
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
③A、B反应温度相等,则平衡常数相等,利用平衡常数计算.
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)用甲醇表示的反应速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(3)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.体系中H2的转化率和CO的转化率相等,不能说明正逆反应速率相等,不一定平衡,故C错误;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BD;
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中PB转化率大于PA,可知PA<PB,故答案为:<;
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=4,V=4L,
故答案为:4.
点评 本题主要考查了热化学方程式的书写、化学平衡状态的判断以及平衡的计算的知识,属于综合知识的考查,难度大.


科目:高中化学 来源: 题型:选择题
| A. | 因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2 | |
| B. | 因为Mg可以与水反应放出H2,所以Ca也可以与水反应放出H2 | |
| C. | 因为CO2的水溶液可以导电,所以CO2是电解质 | |
| D. | 因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
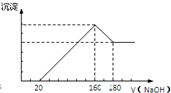 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g) 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.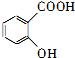 .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$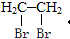
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀氨水 | B. | NaOH溶液 | C. | 硫氰化钾溶液 | D. | Cu2(OH)2CO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.2NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Fe(OH)2露置在空气中加热灼烧可以得到FeO | |
| B. | 为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉 | |
| C. | 要证明某溶液中不含Fe3+而可能含Fe2+,先加氯水,再加少量的KSCN溶液 | |
| D. | 将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水可检验气体产物中的CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com