
分析 铝具有金属光泽,具有金属的通性,在地壳中铝元素的含量处第3位,铝为13号元素,最外层为3个,表现+3价,金属性活泼,在空气容易形成致密的氧化物,因此抗腐蚀性能很好,据此分析进行解答.
解答 解:铝具有金属光泽,为银白色金属,具有良好的导电性,常用作电线成分,具有良好的导热性,常用作炊具,在地壳中铝元素的含量处第3位,铝原子的原子结构示意图为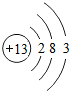 ,元素的正化合价数等于其原子的最外层电子数,可知铝元素常见化合价为+3;铝比铁活泼,但是铝制品比铁制品耐腐蚀,原因是:铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜从而阻止了内部的铝进一步氧化,反应为:2Al+3O2=2Al2O3,
,元素的正化合价数等于其原子的最外层电子数,可知铝元素常见化合价为+3;铝比铁活泼,但是铝制品比铁制品耐腐蚀,原因是:铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜从而阻止了内部的铝进一步氧化,反应为:2Al+3O2=2Al2O3,
故答案为:银白;导电;导热;3;3;+3;活泼;氧化铝;难;2Al+3O2=2Al2O3.
点评 本题主要考查金属铝的性质和用途等方面的知识,可以依据已有的知识结合金属活动性顺序的应用以及原子结构分析,从而培养学生对有关知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量,乙中碱过量 | ||
| C. | 甲中酸过量,乙中铝过量 | D. | 甲、乙中都是铝不足 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.  ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com