
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
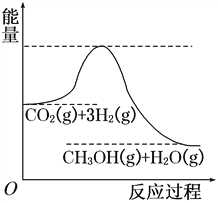
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
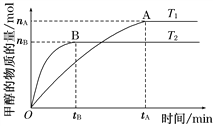
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
【答案】 ![]() 增大 0.15 mol·L-1·min-1 c ③④
增大 0.15 mol·L-1·min-1 c ③④ ![]() 或1-α/2
或1-α/2
【解析】Ⅰ、(1)可逆反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数K=
CH3OH(g)+H2O(g)的化学平衡常数K=![]() ;由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,降低温度平衡向正反应方向移动,平衡常数增大;(2)根据表中数据可得:v(H2)=3v(CO2)=
;由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,降低温度平衡向正反应方向移动,平衡常数增大;(2)根据表中数据可得:v(H2)=3v(CO2)= 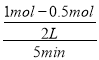 ×3=0.15 mol·L-1·min-1;(3)a.及时分离出CH3OH气体,生成物的浓度降低,反应速率减小,平衡正向移动,选项a错误; b.适当升高温度,反应速率增大,正反应方向为放热反应,升高温度,平衡向逆反应方向移动,选项b错误;c.保持容器的容积不变,再充入1 mol CO2和3 mol H2,相当于增大压强,反应速率增大,平衡正向移动,选项c正确;d.选择高效催化剂,化学反应速率增大,平衡不移动,选项d错误。答案选c;
×3=0.15 mol·L-1·min-1;(3)a.及时分离出CH3OH气体,生成物的浓度降低,反应速率减小,平衡正向移动,选项a错误; b.适当升高温度,反应速率增大,正反应方向为放热反应,升高温度,平衡向逆反应方向移动,选项b错误;c.保持容器的容积不变,再充入1 mol CO2和3 mol H2,相当于增大压强,反应速率增大,平衡正向移动,选项c正确;d.选择高效催化剂,化学反应速率增大,平衡不移动,选项d错误。答案选c;
Ⅱ、(1)根据图像中的数据可知,温度T1时生成甲醇的速率=![]() mol·L-1·min-1,选项①错误;读图可知,温度从T1升高到T2时,甲醇的物质的量降低,说明平衡逆向移动,故此时平衡常数减小,选项②错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,选项③正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故
mol·L-1·min-1,选项①错误;读图可知,温度从T1升高到T2时,甲醇的物质的量降低,说明平衡逆向移动,故此时平衡常数减小,选项②错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,选项③正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故![]() 增大,选项④正确。答案选③④;(2)写出方程式CO2+3H2
增大,选项④正确。答案选③④;(2)写出方程式CO2+3H2![]() CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为
CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( ) ![]()
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3三种溶液,应选用
A. BaCl2 B. HCl C. NaOH D. Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个甲基,A与其它物质之间的转化如下图所示:

(1)C中官能团有___________________ (填官能团名称)。
(2)由A生成B的化学方程式为___________________。
(3)由A生成D的反应类型为___________________,由E生成F的反应类型为_________________。
(4) F的结构简式是___________________。
(5)若 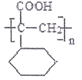 平均分子量为15000,则平均聚合度约为____________________ (填编号)。
平均分子量为15000,则平均聚合度约为____________________ (填编号)。
A. 92 B. 97 C. 100 D. 103
(6)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是__________ (写结构简式);只含有两个甲基的同分异构体有__________种。
①氧原子数与D相同;②相对分子质量比D少54 ;③能发生水解反应。
X的所有同分异构体仅在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________ (填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应 a X (g)![]() b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小 D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、脂肪和蛋白质的说法不正确的是( )
A. 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体
B. 葡萄糖可以发生氧化反应和银镜反应,说明葡萄糖具有还原性
C. 通过盐析从溶液中析出的蛋白质仍能溶解于水
D. 脂肪能发生皂化反应,生成甘油和高级脂肪酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_______mol·L-1。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)___pH(B) (填“>”、“=”或“<”);
现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) _____V(B)(填“>”、“=”或“<”)。
(3)25℃时,0.05mol/LH2SO4溶液的pH=_________;0.05mol/LBa(OH)2溶液中的c(H+)=_______。
(4)某温度下纯水中的c(H+)=2×10-7mol/L,则此时水中的c(OH-)=____________;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中c(OH-)=_________,此时溶液中由水电离产生的c(H+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5molHCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com