
��.������㶨���ܱ������У�����2mol CO2��5mol H2��һ�������·�����Ӧ�� CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��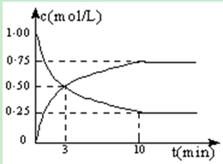
��1���ӷ�Ӧ��ʼ����10min��H2��ת����Ϊ ���� �������£���Ӧ��ƽ�ⳣ��K= �������ijһʱ�̱����¶Ȳ��䣬ֻ�ı�Ũ�ȣ�ʹc(CO2)=1.00mol/L��c(H2)=0.40mol/L��c(CH3OH)=c(H2O)=0.80mol/L����ƽ�� ��ѡ����ţ���
a���������ƶ� b���������ƶ�
c�����ƶ� d����ȷ��ƽ���ƶ�����
��2�����д�ʩ����ʹn(CH3OH)/n(CO2)������� ��ѡ����ţ���
a�������¶� b������He(g)��ʹ��ϵѹǿ����
c����H2O(g)����ϵ�з��� d���ٳ���l mol CH3OH(g)
II������̼����ȼ�ϵ�أ�MCFS����������1889�ꡣ����һ��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650�棬�ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1:1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ����ش��������⣺
��1��A�缫�ĵ缫��Ӧ����ʽΪ ��
��2�������£���ʯī���缫���Դ˵�Դ���һ������CuSO4 ��Һ�����������������������ͬʱֹͣͨ�磬��������Һ�����Ϊ2L����Һ��pH=1��������ˮ�������H+������������������������ʵ����� ��
��.��1�� 90% �� K=" 144" �� a ��2�� c d
II����1�� CO+H2-4e-+2CO32-=3CO2+H2O ��2�� 0.1mol
���������������.��ͼ���ж�CO2��Ũ�Ƚ��ͣ�CH3OH(g)��Ũ�����ߣ� ���������Ϊ2L
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
ʼ�� 2 5 0 0
ת���� 1.5 4.5 1.5 1.5
ƽ���� 0.5 0.5 1.5 1.5
H2��ת����Ϊ4.5��5=0.9
K=1.5/2��1.5/2�£�0.5/2 ��(0.5/2)3��=144
Qc=0.80��0.80�£�1.00��0.403��=10��144����ƽ�������ƶ���
��2��a�����¶�ƽ�������ƶ�����ֵ��С������b�����³���He(g)��ƽ�ⲻ�ƶ�����ֵ���䣬����c��������ƽ�������ƶ�����ֵ�����ȷ��d�ٳ���CH3OH(g)���京����ߣ���ֵ�����ȷ��
II����1��A�缫Ϊ������ע�����Ϊ̼���Σ� CO+H2-4e-+2CO32-=3CO2+H2O ��
��2�����CuSO4 ��Һ�����������������������Ȳ���ͭ���ʣ��������������ӦʽΪ
������4OH- + 4e- = O2��+ 2H2O
������Cu2+ + 2e- = Cu(��)
2H+ + 2e- = H2������
�����������������ȣ����ݵ����غ���ʽΪ4n-2n=0.1��2[����������H+ ��ȥ�������ĵ�H+ ������Һ��ʣ��H+ ] n=0.1mol
���㣺���黯ѧƽ�⼰�绯ѧ�й����⡣


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ˮú��ת���ɺϳ�����Ȼ��ϳɸ�����Ʒ��ʯ����Ʒ�ǻ����ļ�Ϊ��Ҫ������ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
(1)��ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
������������̼��ת���ʵĴ�ʩ�� ��
| A������C(s) | B������H2O(g) | C�������¶� | D������ѹǿ |
 CO(g)+2H2O(g) ��H="-519" kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
CO(g)+2H2O(g) ��H="-519" kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ֽ�ˮ�������Ĺ�ҵ�Ʒ�֮һ������ѭ������Ҫ�漰���з�Ӧ��
I SO2+2H2O+I2��H2SO4+2HI
II 2HI H2+I2
H2+I2
III 2H2SO4 �� 2SO2+O2+2H2O
��1������������Ӧ�������ж���ȷ����_________
a����ӦIII���ڳ����½��� b����ӦI��SO2��ԭ�Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�������в���1molO2��ͬʱ����1molH2
��2��һ���¶��£���2L�ܱ������м���1molHI��g����������ӦII��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��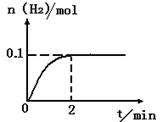
0��2min�ڵ�ƽ����Ӧ����v(HI)= _________ �����¶��£���Ӧ2HI��g�� H2��g��+I2��g����ƽ�ⳣ������ʽΪK=_______________________����ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������_________��ԭ����2����
H2��g��+I2��g����ƽ�ⳣ������ʽΪK=_______________________����ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������_________��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ��
c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
��3��SO2��һ�������¿���������SO3��������ӦΪ��2SO2 (g) + O2(g)  2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)
2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)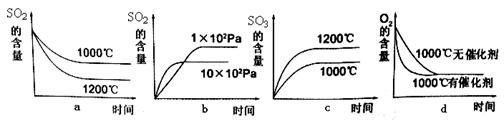
ʵ�ʹ�ҵ����ʹ�õ������ǣ���ѹ��____________________________________ѡ���������ԭ����__________________��
��4��ʵ�������ð�ˮ����SO2�������������Ρ���ȡa�˸���Σ��������е�SO2ȫ����Ӧ������Ӧ����18.4 mol/L��������Һ�������ΧΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�ӦI��II����CH4��H2OΪԭ�����Ʊ��״���
CH4(g)+H2O(g)  CO(g)+3H2 (g)����I CO(g)+2H2(g)
CO(g)+3H2 (g)����I CO(g)+2H2(g)  CH3OH(g) ����II��
CH3OH(g) ����II��
��1����1.0 mol CH4��2.0 mol H2O(g)ͨ���ݻ�Ϊ100L��Ӧ�ң���һ�������·�����ӦI��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��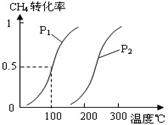
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ____________________��
��ͼ�е�P1_________P2���<������>����=������100��ʱƽ�ⳣ����ֵΪ__________ ��
��2����ѹǿΪ0.1 MPa�����£� ��a mol CO�� 3a mol H2�Ļ�������ڴ��������£��Է���Ӧ�����ɼ״���
�۸÷�Ӧ�ġ�H ____ 0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���________��
| A�������¶� | B����CH3OH(g)����ϵ�з��� |
| C������He��ʹ��ϵ��ѹǿ���� | D���ٳ���1mol CO��3mol H2 |
| ʵ���� | T(��) | N(CO)/n(H2) | P��Mpa�� |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
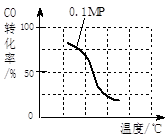
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�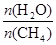 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��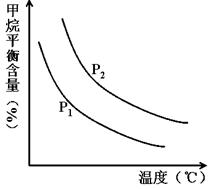
 CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��. ��ˮ��Һ�гȺ�ɫ��Cr2O72-���ɫ��CrO42-������ƽ���ϵ��
Cr2O72-��H2O  2CrO42-��2H+����K2Cr2O7����ˮ���ϡ��Һ�dz�ɫ��
2CrO42-��2H+����K2Cr2O7����ˮ���ϡ��Һ�dz�ɫ��
��1����������Һ�м���NaOH��Һ����Һ�� ɫ����Ϊ ��
��2�����Ѽ���NaOH��Һ�ģ�1�����ټ������ϡH2SO4������Һ�� ɫ����Ϊ ��
��3����ԭ��Һ�м���Ba(NO3)2��Һ����֪BaCrO4Ϊ��ɫ��������ƽ���� �����ƶ�����Һ��ɫ�� ��������������dz�����䡱��
��.ʵ������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺
1.����100mL 0.10mol/L NaOH����Һ��
2.ȡ20.00mL����ϡ������Һ������ƿ�У����μ�2��3�η�̪��ָʾ�������Լ����Ƶı�NaOH��Һ���еζ���
3.�ظ������ζ�����2��3�Σ���¼�������¡�
| ʵ���� | NaOH��Һ��Ũ�� ��mol/L�� | �ζ����ʱ��NaOH��Һ����������mL�� | ����������Һ����� ��mL�� |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪2NO2(g)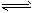 N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
��.��С���ͬѧȡ��������ƿA��B���ֱ������ͬŨ�ȵ�NO2��N2O4�Ļ�����壬�м��ü��Ӽн��� ����A��B���뵽��ʢ��ˮ�������ձ��У���ͼ��ʾ����Ȼ��ֱ��������ձ��м���Ũ�����NH4NO3���塣��ش������й�����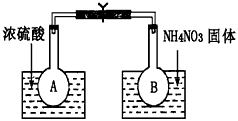
��1���۲쵽��ʵ������Ϊ��_____________________________
��2����ʵ�������֪�������¶ȣ��û�ѧƽ����___________����������桱����Ӧ�����ƶ�����Ӧ��NO2��ת���ʽ�_______________�����������С�����䡱����
��.����֧�ݻ���Ϊ30mL��Ͳ�зֱ����10mLNO2���壬����Ͳǰ�˷�ա�ʵ������е�һ֧��Ͳ�����κβ���������Ϊʵ������۲�ʱ�IJ��ն���
��3��ijͬѧ���ڶ�֧��Ͳ����Ѹ������5mL������ʱ�������ɫ���һ��ʱ���������ɫ�ֱ�dz�ˡ��Խ���һ��ʱ���������ɫ�ֱ�dz��ԭ��________________________��
��4��ijͬѧ������֧��Ͳ����Ѹ������20mL����
�ٸ�ͬѧ�۲쵽�������ǣ�__________________________
���ڴ˹����У��÷�Ӧ�Ļ�ѧƽ�ⳣ����______________(���������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�¶�һ������һ��10L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ���Ը���ͼ�����ݣ���д���пհף�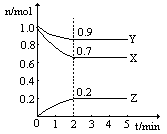
��1���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ ��
��2���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3�������¶Ⱥ�������䣬��n(X)=2mol��n(Y)="3" mol��n (Z)=1mol���÷�Ӧ�� (�����Ӧ�����淴Ӧ��) ������С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶��£������Ϊ5�̵������У������¡��������������ʵ�������ʱ��仯�Ĺ�ϵ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ_________��2�����ã���Ũ�ȱ仯���ãµ�Ũ�ȱ仯��ʾ��ƽ����Ӧ���ʷֱ�Ϊ_________��_________�� 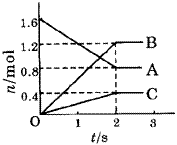
A��B��C�������ʵ����ʵ�����ʱ��仯�Ĺ�ϵͼ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com