
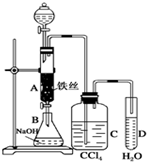
 ij»ÆѧæĪĶāŠ”×éÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÖĘČ”äå±½£®ĻČĻņ·ÖŅŗĀ©¶·ÖŠ¼ÓČė±½ŗĶŅŗä壬ŌŁ½«»ģŗĻŅŗĀżĀżµĪČė·“Ó¦Ę÷A£ØAĻĀ¶Ė»īČū¹Ų±Õ£©ÖŠ£®
ij»ÆѧæĪĶāŠ”×éÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÖĘČ”äå±½£®ĻČĻņ·ÖŅŗĀ©¶·ÖŠ¼ÓČė±½ŗĶŅŗä壬ŌŁ½«»ģŗĻŅŗĀżĀżµĪČė·“Ó¦Ę÷A£ØAĻĀ¶Ė»īČū¹Ų±Õ£©ÖŠ£® £®
£®·ÖĪö £Ø1£©±½ÓėŅŗäå·¢ÉśČ”“ś·“Ӧɜ³Éäå±½”¢HBr£»
£Ø2£©äåŅ×»Ó·¢£»
£Ø3£©ä唢±½Ņ×ČÜÓŚĖÄĀČ»ÆĢ¼£¬¶ųHBr²»ÄÜ£»
£Ø4£©¼Ó³É·“Ó¦Ź±²śĪļÖ»ÓŠŅ»ÖÖ£¬Č”“ś·“Ó¦Ź±Éś³ÉHBr£¬HBrČÜŅŗĻŌĖįŠŌ£¬ĒŅÓėĻõĖįŅų·“Ӧɜ³É³Įµķ£®
½ā“š ½ā£ŗ£Ø1£©AÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
£Ø2£©·“Ó¦Ź±¹Ū²ģµ½AÖŠ·“Ó¦ŅŗĪ¢·Š²¢³äĀśŗģ×ŲÉ«µÄÕōĘų£¬²śÉśøĆĻÖĻóµÄŌŅņŹĒ±½ÓėŅŗäåµÄČ”“ś·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬äåŅ×»Ó·¢£¬
¹Ź“š°øĪŖ£ŗ±½ÓėŅŗäåµÄČ”“ś·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬äåŅ×»Ó·¢£»
£Ø3£©CÖŠŹ¢·ÅCCl4µÄ×÷ÓĆŹĒ³żČ„HBrĘųĢåÖŠµÄäåÕōĘų”¢±½£¬¹Ź“š°øĪŖ£ŗ³żČ„HBrĘųĢåÖŠµÄäåÕōĘų”¢±½£»
£Ø4£©ÄÜÖ¤Ć÷±½ŗĶŅŗäå·¢ÉśµÄŹĒČ”“ś·“Ó¦£¬¶ų²»ŹĒ¼Ó³É·“Ó¦£¬æÉĻņŹŌ¹ÜDÖŠ¼ÓČė×ĻÉ«ŹÆČļŹŌŅŗ£Ø»ņĻõĖįĖį»ÆµÄAgNO3ČÜŅŗ£©£¬³öĻÖČÜŅŗ±äĪŖŗģÉ«£Ø»ņ²śÉśµ»ĘÉ«³Įµķ£©ĻÖĻóŌņÄÜÖ¤Ć÷£¬
¹Ź“š°øĪŖ£ŗ×ĻÉ«ŹÆČļŹŌŅŗ£Ø»ņĻõĖįĖį»ÆµÄAgNO3ČÜŅŗ£©£»ČÜŅŗ±äĪŖŗģÉ«£Ø»ņ²śÉśµ»ĘÉ«³Įµķ£©£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄÖʱøŹµŃ飬ĪŖøßĘµæ¼µć£¬°ŃĪÕÖʱøŹµŃéŌĄķ”¢ÓŠ»śĪļµÄŠŌÖŹĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāČ”“śÓė¼Ó³É·“Ó¦µÄĢŲµć£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ£¬µČpHµÄ°±Ė®”¢KOHČÜŅŗ”¢Ba£ØOH£©2ČÜŅŗÖŠ£ŗc£ØNH4+£©=c£ØK+£©=2c£ØBa2+£© | |
| B£® | ³£ĪĀŹ±ĻņNH4HSO4ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮpH=7£ŗc£ØNH4+£©+c£ØNa+£©=c£ØSO42-£© | |
| C£® | AgClµÄKsp=1.8”Į10-10 mol2•L-2£¬ŌŚČĪŗĪŗ¬AgCl¹ĢĢåµÄČÜŅŗÖŠ£¬c£ØAg+£©=c£ØCl-£©ĒŅAg+ÓėCl-ÅØ¶ČµÄ³Ė»żµČÓŚ1.8”Į10-10 mol2•L-2 | |
| D£® | ½«10 mL 0.1 mol/L Na2SO3ČÜŅŗÖšµĪµĪ¼Óµ½10 mL 0.1 mol/LŃĪĖįÖŠ£ŗc£ØNa+£©£¾c£ØCl-£©£¾c£ØHSO3-£©£¾c£ØSO32-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | »ÆŗĻĪļAµÄ·Ö×ÓŹ½ĪŖC15H21O3 | |
| B£® | »ÆŗĻĪļAŹĒ·¼Ļć×å»ÆŗĻĪļ | |
| C£® | »ÆŗĻĪļAæÉŅŌ·¢ÉśČ”“ś·“Ó¦”¢¼Ó³É·“Ó¦”¢õ„»Æ·“Ó¦ŗĶŅų¾µ·“Ó¦ | |
| D£® | 1mol»ÆŗĻĪļA×ī¶ąæÉÓė1molH2·¢Éś¼Ó³É·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2 mol HI£Øg£© | B£® | 2 mol H2£Øg£©ŗĶ1 mol I2£Øg£© | ||
| C£® | 1 mol H2£Øg£©ŗĶ2 mol I2£Øg£© | D£® | 1 mol I2£Øg£©ŗĶ2 mol HI£Øg£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £¬øĆ·Ö×ÓÖŠµŖŌ×ÓµÄŌӻƷ½Ź½ĪŖsp2ŗĶsp3£®
£¬øĆ·Ö×ÓÖŠµŖŌ×ÓµÄŌӻƷ½Ź½ĪŖsp2ŗĶsp3£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
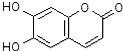
| A£® | MµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ172 | |
| B£® | 1mol M×ī¶ąÄÜÓė3mol Br2·¢Éś·“Ó¦ | |
| C£® | MÓė×ćĮæµÄNaOHČÜŅŗ·¢Éś·“Ó¦Ź±£¬ĖłµĆÓŠ»ś²śĪļµÄ»ÆѧŹ½ĪŖC9H4O5Na4 | |
| D£® | 1mol MÓė×ćĮæNa·“Ó¦ÄÜÉś³É1mol H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
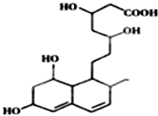
| A£® | ÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦ | |
| B£® | ÄÜ·¢Éś¼Ó³É”¢õ„»Æ”¢Ńõ»Æ·“Ó¦ | |
| C£® | 1moløĆĪļÖŹÓė×ćĮæNa·“Ó¦£¬²śÉś2.5gH2 | |
| D£® | ÄÜŹ¹äåĖ®ŗĶĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ĶŹÉ«ŌĄķĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¢Ū
¢Ū £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
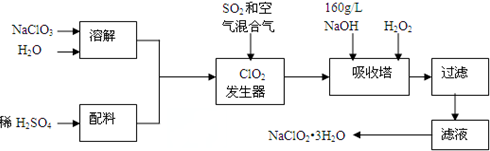
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com