
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
分析 今有原子序数依次培大的A、B、C、D、E、F六种元素,已知A、C、E三元素原子的最外层共有10个电子,且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水,D、F的次外层电子数为x+4,则:x+4=8,解得:x=4,D为Si元素、F为Cl元素;A、C、E三元素原子的最外层共有10个电子,且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水,则C为Al元素,结合原子序数大小可知E为S元素,A的最外层电子数为:10-3-6=1,为ⅠA族元素,结合能够溶解氢氧化铝可知A为Na元素,B的原子序数大于Na小于Al,则B为Mg元素,据此进行解答.
解答 解:今有原子序数依次培大的A、B、C、D、E、F六种元素,已知A、C、E三元素原子的最外层共有10个电子,且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水,D、F的次外层电子数为x+4,则:x+4=8,解得:x=4,D为Si元素、F为Cl元素;A、C、E三元素原子的最外层共有10个电子,且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水,则C为Al元素,结合原子序数大小可知E为S元素,A的最外层电子数为:10-3-6=1,则A为Na元素,的原子序数大于Na小于Al,则B为Mg元素,
(1)根据分析可知,B为Mg元素,E为S元素,F为Cl元素,
故答案为:Mg;S;Cl;
(2)A的最高价氧化物的水化物化学式为NaOH、B的最高价氧化物的水化物化学式为Al(OH)3,二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)D为Si元素,E为S元素,非金属性Si<S,则氢化物稳定性:H2S>SiH4,
故答案为:H2S;SiH4;
(4)A、B、E、F形成的简单离子分别为:Na+、Mg2+、S2-、Cl-,电子层越多,离子半径越大,电子层相同时核电荷数越大,离子半径越小,则四种离子半径大小分别为:S2->Cl->Na+>Mg2+,
故答案为:S2->Cl->Na+>Mg2+.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | ③>②>① | B. | ②>①>③ | C. | ①>②>③ | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用铝片,改用铝粉 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 不用稀硫酸,改用浓硝酸 | D. | 加入少量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨分子的电子式: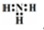 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: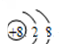 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
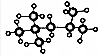 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com