
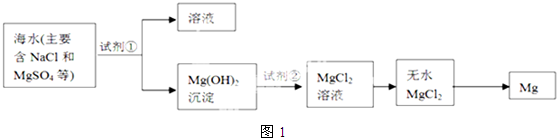
分析 (1)根据题中工业流程图可知,海水中加入碱,使镁离子沉淀,得到氢氧化镁,氢氧化镁溶于盐酸得氯化镁溶液,氯化镁溶液在酸性条件下蒸发得无水氯化镁,电解熔融的氯化镁可得镁.
①利用复分解反应的条件及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
②根据框图可知氢氧化镁和盐酸反应得到氯化镁、水来分析;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
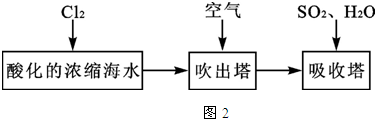
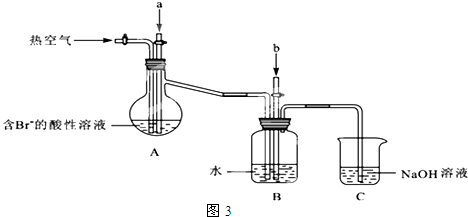
(2)①利用氧化还原反应原理制取溴单质;
②溴易挥发;
③硫酸根离子和盐酸酸化的氯化钡溶液反应生成难溶性的白色沉淀;
④溴、氯气和二氧化硫都有毒,不能直接排空.
解答 解:(1)①使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:氢氧化钠(NaOH);过量;
②根据框图可知氢氧化镁和盐酸反应得到氯化镁、水,所以试剂②的名称是盐酸,
故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,
故答案为:C;
(2)①要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
②溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,
故答案为:吹出Br2;
③溴有强氧化性,能和二氧化硫发生氧化还原反应而生成溴离子和硫酸根离子,硫酸根离子和盐酸酸化的氯化钡溶液反应生成难溶性的白色硫酸钡沉淀,所以硫酸根离子的检验方法为:取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-,
故答案为:取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-;
④氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,所以C的作用是:吸收未反应的Cl2、Br2和SO2,
故答案为:吸收未反应的Cl2、Br2和SO2.
点评 本题考查镁的制备,明确海水中镁的制备的流程及试剂的选择来分析解答,注意MgO的熔点高是学生解答中易忽略的地方,制备镁利用电解法,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | “K”属于芳香烃 | |
| B. | “K”的苯环上的一硝基取代产物有5种 | |
| C. | “K”中含有三种官能团 | |
| D. | 11mol“K”最多可和6molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A与B互为同系物 | |
| B. | A与B都能与溴的四氯化碳溶液发生加成反应 | |
| C. | 在一定条件下,A与B均能发生取代反应 | |
| D. | A与B都能与碳酸氢钠反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

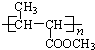
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲和乙 | B. | 乙和丙 | C. | 丙和丁 | D. | 丁和甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和NaHCO3 | B. | NaHCO3和Na2CO3 | C. | NaOH和Na2CO3 | D. | 只有Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com