

【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知![]() 能发生如下反应
能发生如下反应
_______NaNO2+_____HI——_________NO↑+_________I2+_______NaI+____H2O
(1)配平上面方程式。
(2)若有1 mol的氧化剂被还原,则被氧化的还原剂是 ________mol。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是_____(填字母)。
A.①②④ B.③⑤ C. ①②③⑤ D.①②⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______
【答案】![]() 4 2 1 2 2 1 D NaNO2+NH4Cl=N2↑+NaCl+2H2O
4 2 1 2 2 1 D NaNO2+NH4Cl=N2↑+NaCl+2H2O
【解析】
(1)在反应中N、I元素化合价发生了变化,先根据元素化合价升降总数相等,配平参加氧化还原反应的元素,再根据原子守恒,配平未参加氧化还原反应的元素,得到方程式;
(2)根据元素化合价升高与降低的数值,确定还原剂的物质的量多少;
(3)在酸性条件下NaNO2可以将I-氧化为I2,I2遇淀粉溶液变为蓝色检验;
(4)NaNO2与NH4Cl发生氧化还原反应产生N2、NaCl、H2O。
(1)在该反应中,N元素从+3降低到+2,共降低1价,碘元素从-1升高到0价,反应产生一个碘单质共升高2价,依据化合价升降总数相等,NaNO2、NO的系数是2,HI系数是2,I2的系数是1,再配平未参加氧化还原反应的元素,Na反应前有2个,则NaI的系数是2,有2个I未参加氧化还原反应,所以HI的系数改为4,根据H原子个数反应前后相等,可知H2O的系数是2,所以配平后的化学方程式为2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,因此配出系数由前到后依次为:2、4、2、1、2、2;
(2)在上述反应中NaNO2为氧化剂,HI为还原剂,1 molNaNO2反应,得到1 mol电子,根据氧化还原反应中元素化合价升降总数相等,可知被氧化的还原剂的物质的量是1 mol;
(3)根据上述反应可知:在酸性条件下NaNO2可以将I-氧化为I2,可根据I2遇淀粉溶液变为蓝色检验,故鉴别NaNO2和NaCl可以用①水、②碘化钾淀粉试纸、⑤食醋,故需要的物质序号为①②⑤,合理选项是D;
(4)NaNO2与NH4Cl发生氧化还原反应产生N2、NaCl、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式为:NaNO2+NH4Cl=N2↑+NaCl+2H2O。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.Na+、Fe2+、Cl-、![]() -B.K+、
-B.K+、![]() 、Cl-、
、Cl-、![]()
C.Ca2+、Mg2+、![]() 、
、![]() D.Na+、Cl-、
D.Na+、Cl-、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ:甲组同学用质量法,按如图所示的实验流程进行实验:
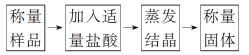
(1)实验时,蒸发结晶操作中,除了铁架台(带铁圈)、酒精灯外,还要用到的仪器是________。
(2)有同学认为“加入适量盐酸”不好控制,应改为“加入过量盐酸”,便于操作且不影响测定的准确性,该观点________(填“正确”或“不正确”),其原因是___________________________。
(3)若实验中测得样品质量为46.4g,蒸发后固体质量为40.95g,则碳酸钠的质量分数为________(保留3位有效数字)。
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数________(填“偏大”“偏小”或“无影响”)。
方案Ⅱ:乙组同学的主要实验流程如下:
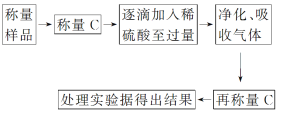
按如图所示装置进行实验:
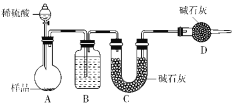
(5)装置B中的试剂为_______在装置C中装碱石灰来吸收净化后的气体,装置D的作用是________________________。
(6)有的同学认为为了减小实验误差,在反应前后都通入N2,反应后通入N2的目的是________________________________________________________________________。
方案Ⅲ:气体分析法
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B中溶液最好采用________(填序号)使测量误差较小。

a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以钛白酸废液(主要含有TiO2+、Fe2+、Ca2+、SO![]() 等)为原料,获取磷酸钛(2TiO2·P2O5·H2O)和氧化铁黄(FeOOH)的部分流程如图:
等)为原料,获取磷酸钛(2TiO2·P2O5·H2O)和氧化铁黄(FeOOH)的部分流程如图:
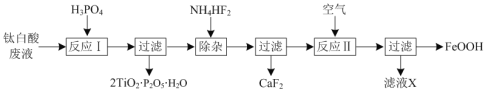
(1)反应Ⅰ中生成2TiO2·P2O5·H2O的离子方程式为___。
(2)反应Ⅱ时溶液的pH约为4,写出反应Ⅱ中Fe2+发生反应的离子方程式:___。
(3)碱性条件下,FeOOH可以被次氯酸钠氧化成Na2FeO4。该反应的离子方程式为___。
(4)TiO2是两性氧化物,TiO2与KHSO4熔融时反应生成TiOSO4的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
B.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
C.甲烷的燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= -890.3 kJ·mol-1
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S↓+SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型钴基电催化剂作用下,用石墨、铁做电极材料,可将CO2和水转化为甲酸。其反应原理如图所示,下列说法不正确的是( )
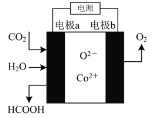
A.电极a为铁,与电源的负极相连
B.反应时化学能转化成电能
C.电极a上发生的反应为:CO2+2e-+2H2O=HCOOH+O2-
D.反应时,O2-向阳极处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: ____________________。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:______________________
![]() Ce3++
Ce3++![]() H2O2+
H2O2+![]() H2O===
H2O===![]() Ce(OH)4↓+
Ce(OH)4↓+![]() ________
________
(3)As可以与NaClO的水溶液反应,生成其最高价含氧酸(H3AsO4),写出该反应的化学方程式 : _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
________NaBiO3+________Mn2++________________![]() ________Na++________Bi3++_______________+______________。
________Na++________Bi3++_______________+______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)写出下列反应的化学方程式。
①乙烯通入溴的四氯化碳溶液中:______________________________________。
②苯与浓硝酸、浓硫酸混合后加热至![]() 发生反应:___________________。
发生反应:___________________。
(2)苯可以和浓硫酸发生取代反应生成苯磺酸(![]() ),根据质量守恒定律,可判断出另一种产物为___________________。
),根据质量守恒定律,可判断出另一种产物为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com