
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示。
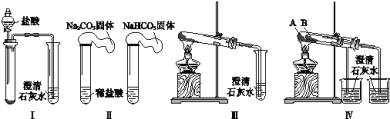
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是___(填化学式)。
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是___和___。
(3)与Ⅲ相比,IV的优点是___(填选项序号)。
a.Ⅳ比Ⅲ复杂
b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(4)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是___。
【答案】Na2CO3 2NaHCO3![]() Na2CO3+CO2↑+H2O CO2+Ca(OH)2═CaCO3↓+H2O c NaHCO3
Na2CO3+CO2↑+H2O CO2+Ca(OH)2═CaCO3↓+H2O c NaHCO3
【解析】
(1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳;
(3)根据两个实验的区别分析;
(4)根据碳酸氢钠的性质分析。
(1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多,碳酸钠中含碳量为![]() ×100%=11.3%,而碳酸氢钠中含碳量为
×100%=11.3%,而碳酸氢钠中含碳量为![]() ×100%=14.3%,所以碳酸钠放出二氧化碳量少,
×100%=14.3%,所以碳酸钠放出二氧化碳量少,
故答案为:Na2CO3;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳:2NaHCO3![]() Na2CO3+CO2↑+H2O,生产的二氧化碳通入澄清石灰水变浑浊:CO2+Ca(OH)2═CaCO3↓+H2O,
Na2CO3+CO2↑+H2O,生产的二氧化碳通入澄清石灰水变浑浊:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;
Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,
故答案选c;
(4)碳酸钠直接加热不产生气体,而碳酸氢钠不直接加热就产生气体,就更说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠,
故答案为:NaHCO3。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列关于生活中遇到的化学问题的描述不正确的是( )
A. 曾经风靡一时的DDT是卤代烃的一种
B. 维纶、油脂、天然橡胶、脲醛树脂都是由高分子化合物组成的物质
C. 甲醛水溶液可以防腐,但是不能用于食品类的保鲜剂
D. 可以将浸泡过高锰酸钾溶液的硅藻土于水果一起保存来达到水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Ⅱ、Ⅲ三个容积均为1 L的恒容密闭容器中均投入1 mol CO2和3 mol H2,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
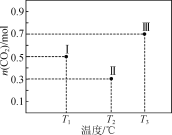
A.该正反应ΔH<0
B.T1时,该反应的平衡常数为![]()
C.10 min内,容器Ⅱ中的平均速率:v(H2)=0.07 mol·L-1·min-1
D.10 min后,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。

(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应:![]()
(1)配平上述化学方程式并标出该反应中电子转移情况_____________________________
(2)该反应中的氧化剂是__________ ,被氧化的元素是_____________。
(3)1 mol Cl2参加反应,被氧化的NH3 的物质的量是_____________mol。
(4)若有68g NH3参加反应,电子转移的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
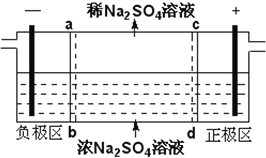
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸工业的 SO2 尾气、氨水、石灰石、焦炭等为原料,可以得到有重要应用价值的 CaS、(NH4)2SO3等物质,流程如下:
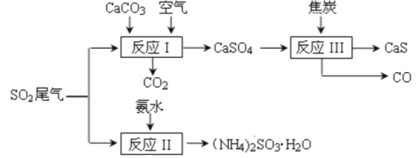
下列说法不正确的是
A. 反应Ⅰ的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2
B. 生产中反应Ⅰ中需鼓入足量的空气以保证 SO2 充分氧化生成 CaSO4;向反应Ⅱ溶液中加入适量还原性很强的物质,其目的是防止(NH4)2SO3被氧化
C. 反应Ⅲ中氧化剂与还原剂的物质的量之比为1:4
D. 将反应Ⅱ后的溶液加热到有较多固体析出,再用余热将液体蒸干,可得(NH4)2SO3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于阴影部分的是( )

A.CO + CuO ![]() CO2 + Cu
CO2 + Cu
B.Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
C.Fe+H2SO4=FeSO4+H2↑
D.N2+3H2 ![]() 2NH3
2NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com