
【题目】硫单质及其化合物在化工生成等领城应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法 1: 燃煤中加入生石灰,将SO2转化为 CaSO3,再氧化为CaSO4。
已知:a. CaO(s) +CO2 (g)=CaCO3 △H=-1 78.3kJmol-1
b. 2CaCO3(s) +2SO2(g) +O2(g)=2CaSO4(s) +2CO2(g) △H=-2762.2kJmol-1
c.2 CaSO3(s) + O2(g)=2CaSO4(s) △H =-2314.8 kJmol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_____________。
②方法 2:用氨水将SO2转化为NH4HSO3 ,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() = 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
= 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
(2)煤制得的化工原料气中含有羰基硫(O=C =S),该物质可转化为H2S,反应为COS(g)+ H2( g ) ![]() H2S(g) +CO(g) △H > 0。
H2S(g) +CO(g) △H > 0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是________________(填字母)。
a.COS的浓度保持不变 b. 化学平衡常数不再改变
c.混合气体的密度不再改变 d. 形成 2 mol H-S 键的同时形成 1 mol H-H 键
②T℃时 ,在恒容的密闭容器中 ,将定量的CO和H2S 混合加热并达到下列平衡:H2S(g) + CO(g)![]() COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示: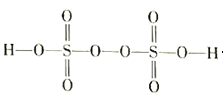
①在Ag+催化作用下,S2O82-能与 Mn2+ 在水溶液中发生反应生成SO42-和 MnO4-,1 molS2O82-能氧化的 Mn2+ 的物质的量为_____________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
(4)NaHS 可用作处理含 Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
【答案】CaO (s) + SO2(g}= CaCO3(s) △H=-402.0kJmoj-1 6 bc 4 66. 7% 0.4 2SO42--2e一= S2O82- 4.0×10-53
【解析】
(1)①已知:a. CaO(s)+CO(g)=CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
根据盖斯定律(b-c)/2+a即得到CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0kJ·mol-1。
②Ka1=c(H+)c(HSO3-)/c(H2SO3)、Ka2=c(H+)c(SO32-)/c(HSO3-),则Ka1Ka2=c2(H+)·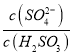 =1.5×10-2×1.0×10-7,解得c(H+)=1×10-6,溶液的pH为6。
=1.5×10-2×1.0×10-7,解得c(H+)=1×10-6,溶液的pH为6。
(2)COS(g) +H2(g)![]() H2S(g)+CO(g) ΔH>0。
H2S(g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,a.COS的浓度保持不变说明化学反应达到平衡状态了;b.化学平衡常数只和温度有关,不受浓度影响,所以不能作为判断平衡的依据;c.混合气体的密度=m/V,恒容V定值,都是气体所以m不变,故c不能;d.形成2molH-S键的同时形成1mol H-H键说明正逆反应速率相等,故可以作为判断平衡的标志。答案:bc。
②T1℃时H2S(g)+ CO(s) ![]() COS(g)+H2(g)的K=c(COS)c(H2)/c(CO)c(H2S)=0.25,COS(g)+H2(g)=H2S(g)+ CO(s)的K=c(CO)c(H2S)/c(COS)c(H2))=1/0.25=4。
COS(g)+H2(g)的K=c(COS)c(H2)/c(CO)c(H2S)=0.25,COS(g)+H2(g)=H2S(g)+ CO(s)的K=c(CO)c(H2S)/c(COS)c(H2))=1/0.25=4。
③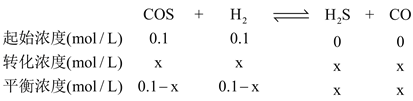
K=x·x/(0.1-x)·(0.1-x)=4,解得x=0.0667,COS的转化率为0.0667/0.1×100%=66.7%。
3)①根据方程式5S2O82-+ 2Mn2+ +8H2O=10SO42-+2MnO4-+16H+可知1mol S2O82-能氧化的Mn2+的物质的量为0.4mol。
②用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。根据氧化还原原理知阳极SO42-失电子,则阳极的电极反应式为2SO42--2e-=S2O82-。
(4) 由已知反应a. Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) K=l.75×l038
HgS(s) + H+(aq) K=l.75×l038
b. HS-( aq) ![]() H+(aq) + S2-( aq) Ka2= 7.0×l 0-15
H+(aq) + S2-( aq) Ka2= 7.0×l 0-15
反应b-a得HgS(s) ![]() Hg2+(aq) + S2- (aq),则Ksp(HgS) =
Hg2+(aq) + S2- (aq),则Ksp(HgS) =![]() =4.0×10-53。
=4.0×10-53。


科目:高中化学 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
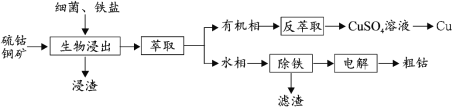
回答下列问题:
(1)Cu2+的生物浸出原理如下:
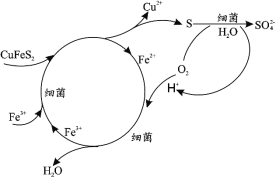
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
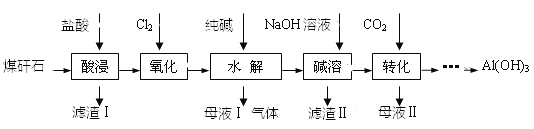
(1)“酸浸”过程中发生的主要反应的离子方程式为_______________。
(2)“氧化”的目的是_____________。检验Fe3+的方法是______________。
(3)滤渣I的主要成份________。溶于酸的反应方程式______________。
(4)②“转化”时主要反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 5mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7gB.3.6gC.5.4gD.6.75g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如下图所示(不考虑C2O42-的水解)。下列叙述正确的是
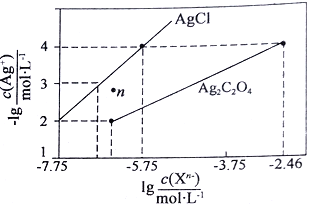
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4 沉淀
D.Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8gNH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.5.6g金属铁与足量氯气充分反应时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为______。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:______________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是______。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
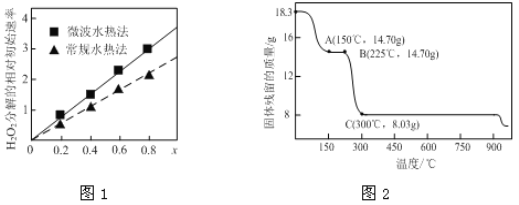
①通过计算确定A点剩余固体的化学成分为________________(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_________________________________________。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。请完成列空白:
(1)铝元素在周期表中的位置为_____
(2)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6mol电子时,所得气体的物质的量为_____mol
(3)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为_____
(4)如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
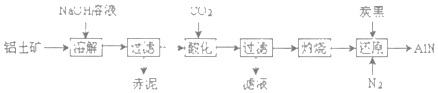
①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:2Na2SiO3+2NaAIO2+2H2O═Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_____(写出化学式)。
②“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3滤液的主要成分为_____(写化学式)。
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com