
按要求写出下列反应的离子方程式:
(1)在NH4Cl溶液中加入NaOH溶液,并加热
________________________________________________________________________。
(2)在NH4Cl溶液中滴加NaOH溶液
________________________________________________________________________。
(3)NH4Cl溶液呈酸性的原因
________________________________________________________________________。
(4)在饱和NH4Cl溶液中滴加NaAlO2,产生刺激性气味的气体和白色沉淀
________________________________________________________________________。
★ ★★
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.在分子中,两个成键的原子间的距离叫做键长
B.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中不存在氢键的是 ( )
A.液态甲烷中甲烷分子之间
B.液态氟化氢中氟化氢分子之间
C.一水合氨分子中的氨分子与水分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 (1)1∶3
(2)①2NO2+2NaOH===NaNO3+NaNO2+H2O
②NaNO2
(3)①Na2CO3+2NO2===NaNO3+NaNO2+CO2
②NaNO3:0.05 mol NaNO2:0.15 mol 0.5
解析 (1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3: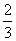 V(NO),处理NO2需NH3:
V(NO),处理NO2需NH3: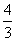 V(NO2),则
V(NO2),则
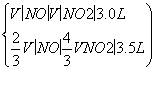
解得V(NO)=0.75 L
V(NO2)=2.25 L
V(NO)∶V(NO2)=1∶3。
(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。
②NO中氮的化合价为+2价,NO2中氮的化合物为+4价,二者1∶1混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
(3)②n(NO2)=0.15 mol,n(NO)=0.05 mol
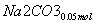 +
+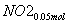 +
+ ===
===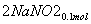 +CO2
+CO2
则单独与Na2CO3反应的NO2为0.15 mol-0.05 mol=0.1 mol
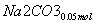 +
+ ===
===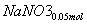 +
+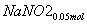 +CO2
+CO2
所以共生成NaNO3:0.05 mol,NaNO2:0.15 mol
c(Na2CO3)= =0.5 mol·L-1。
=0.5 mol·L-1。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
2014高考涉及氮及化合物选项正误判断,正确的划“√”,错误的划“×”
(1)NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验( )
(2014·广东理综,9C)
(2)将可调高度的铜丝伸入稀HNO3中,溶液变蓝,则Cu与稀HNO3发生置换反应( )
(2014·广东理综,22C)
(3)实验室用锌粒、稀HNO3以及试管、带导管的橡皮塞可制取H2( )
(2014·安徽理综,9C)
(4)由于反应物浓度越大,反应速率越快,因而常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完( )
(2014·安徽理综,12B)
(5)制二氧化氮时,用水或NaOH溶液吸收尾气( )
(2014·天津理综,2D)
(6)用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2( )
(2014·重庆理综,2B)
(7)Cu溶于稀HNO3的离子方程式为Cu+2H++NO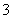 ===Cu2++NO2↑+H2O( )
===Cu2++NO2↑+H2O( )
(2014·江苏,7A)
(8)NH3、O2和HNO3三种物质中,任意两种物质在一定条件下均能发生反应( )
(2014·江苏,8B)
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
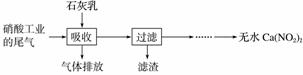
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是________________________;滤渣可循环使用,滤渣的主要成分是________(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致__________________;若n(NO)∶n(NO2)<1∶1,则会导致________________________________________________________________________。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3->D-
查看答案和解析>>
科目:高中化学 来源: 题型:
第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18。根据结构填空:
(1)写出元素名称:A__________,B__________,C__________,D__________。
(2)D的简单离子是________。
(3)元素的氢氧化物碱性最强的是________。
(4)B与D两原子间形成化合物的化学式是______________。
(5)写出A、B的电离能顺序:________。
(6)写出C基态原子的电子排布式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com