
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:

(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。

①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
(1)1∶2
(2)NH4Cl+2HCl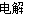 3H2↑+NCl3 (3)C
3H2↑+NCl3 (3)C
(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+10I-+8H+=4H2O+5I2+2Cl- ③滴下最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cV×10-2 g
(5)Fe(OH)3 ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-
【解析】(1)设氧化产物Na2SO4、还原产物ClO2的物质的量分别为x、y,则2x=y,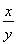 =
=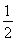 。
。
(2)根据电解时有H2、NCl3生成,所以电解时反应的化学方程式为NH4Cl+2HCl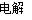 3H2↑+NCl3。
3H2↑+NCl3。
(3)因为ClO2能和水、碱反应,所以应用浓硫酸除去NH3。(4)玻璃液封管中的水可以吸收残余的ClO2气体,并使锥形瓶内外压强相等。ClO2可把I-氧化成I2,离子方程式为2ClO2+10I-+8H+=4H2O+5I2+2Cl-,I2+2S2O32-=2I-+S4O62-
ClO2 ~ 5S2O32-
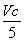 ×10-3 mol V×10-3L×c mol·L-1
×10-3 mol V×10-3L×c mol·L-1
=Vc×10-3mol
所以m(ClO2)=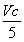 ×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
(5)处理ClO2-可用Fe2+还原,其氧化产物为Fe(OH)3,离子方程式为ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-。


科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol· L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是( )。
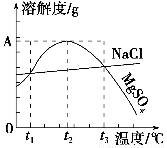
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液的物质的量浓度减小
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如:
反应①

化合物Ⅱ可由化合物Ⅲ合成:
C4H7Br CH3CHCHOHCH2
CH3CHCHOHCH2
Ⅲ Ⅳ

(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:

下列有关判断中不正确的是 ( )。
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,测得铜的质量分数偏大
C.方案一可能产生氢气,方案二可能剩余铜
D.实验室中方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
实验是化学研究的基础,下列各图所示的实验方法、装置或操作正确的是 ( )。

查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题11常见有机化合物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.淀粉、油脂和蛋白质都是高分子化合物,且它们均为混合物
B.煤、石油和天然气都是化石燃料,且它们均不能再生
C.果糖、蔗糖和麦芽糖都能发生水解反应,且产物均为葡萄糖
D.乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 4-1-2海水资源的开发利用练习卷(解析版) 题型:选择题
从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com