
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
分析 A.蔗糖与稀硫酸可发生水解反应生成葡萄糖和果糖;
B.纤维素不与乙酸酯化,与乙酸酐酯化;
C.淀粉溶液为胶体,不能透过半透膜,而葡萄糖水可以;
D.温度超过55℃淀粉与碘不发生变蓝现象.
解答 解:A.蔗糖与稀硫酸可发生水解反应生成葡萄糖和果糖,蔗糖遇浓硫酸可发生碳化现象,故A错误;
B.纤维素不与乙酸酯化,与乙酸酐酯化生成乙酸纤维素酯,故B错误;
C.淀粉溶液为胶体,不能透过半透膜,而葡萄糖水可以,则除去淀粉中的葡萄糖杂质,可用加水渗析的方法,故C正确;
D.温度超过55℃淀粉与碘不发生变蓝现象,应为常温或温热,热溶液中不能检验淀粉,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物官能团与性质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ②③④⑥ | D. | ①②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应,起始时二者产生氢气的速率基本相等 | |
| B. | 100mL 1mol/L的盐酸和50mL 2mol/L的盐酸分别与足量的锌反应,二者放出氢气的速率和质量均相等 | |
| C. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等 | |
| D. | 100mL 0.1mol/L的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量与后者相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Vl=V2,且混合溶液pH<7,则必有c1<c2 | |
| B. | 若混合溶液的pH=7,则混合溶液中c(Na+)=c (CH3COO-)+c(CH3COOH ) | |
| C. | 若混合溶液的pH>7,则混合溶液中c(Na+)<c( CH3COO-) | |
| D. | 若Vl=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
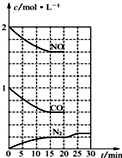 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com