
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(A);
(2)实验1、2温度相同,平衡常数相同,平衡时A的浓度均为0.8mol/L,则起始浓度相等,实验2到达平衡时间较短,反应速率较快,应使用催化剂;
(3)实验1、3温度相同,平衡常数相同,平衡时实验3中的A的浓度较大,则平衡时生成物浓度也较大,则平衡时实验3中A的浓度变化量大,实验3中A的起始浓度比实验1中大,故30min内实验3中A的浓度变化量较大;
(4)A的起始浓度相等,实验4中平衡时A的浓度较大,说明升高温度平衡逆向移动;
(5)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比.
解答 解:(1)在实验 1,反应在10min~20min 内△c(A)=(1.6-1.3)mol/L=0.3mol/L,故v(A)=$\frac{0.3mol/L}{20min-10min}$=0.03mol/(L.min),
故答案为:0.03;
(2)实验1、2温度相同,平衡常数相同,平衡时A的浓度均为0.8mol/L,则起始浓度相等,即A 的初始浓度 C2=2.0mol/L,实验2到达平衡时间较短,反应速率较快,应使用催化剂,
故答案为:2.0;使用催化剂;
(3)实验1、3温度相同,平衡常数相同,平衡时实验3中的A的浓度较大,则平衡时生成物浓度也较大,则平衡时实验3中A的浓度变化量大,实验3中A的起始浓度比实验1中大,即C3>2.0mol/L,故30min内实验3中A的浓度变化量较大,故反应速率v3>v1,
故答案为:>;>;
(4)A的起始浓度相等,实验4中平衡时A的浓度较大,说明升高温度平衡逆向移动,而升高温度平衡向吸热反应移动,故正反应为放热反应,
故答案为:放热;温度升高,A的浓度增大,平衡向吸热方向移动;
(5)3A(g)?2B(g)+D(g)的平衡常数表达式K=$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$,
故答案为:$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
点评 本题考查化学平衡计算与影响因素,侧重考查学生对数据的分析处理能力,难度中等.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
某铁的氧化物样品,用5mol/L的盐酸140mL恰好完 全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
A.Fe5O7 B.Fe2O3 C.Fe3O4 D. Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
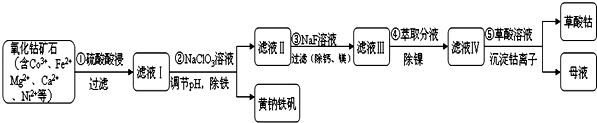
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
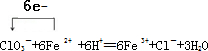 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 浓度为0.06mol/L.
浓度为0.06mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 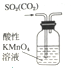 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 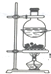 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 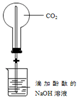 装置,做喷泉实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com