
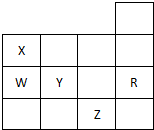
| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
分析 根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.根据物质的在常压下的存在形式可知,常压下S、P为固体,而Br为液体;
B.同周期中,从左到右,元素的非金属性逐渐增强;
C.Y的阴离子核外有18个电子,Z的阴离子核外有36个电子;
D.根据水分子之间含有氢键进行比较.
解答 解:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A.常压下S、P为固体,而Br2为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误;
B.同周期中,从左到右,元素的非金属性逐渐增强,即非金属性Y>W,故B正确;
C.Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故C错误;
D.Y为S元素,硫化氢分子之间不存在氢键,水分子之间含氢键,沸点大于Y的氢化物,故D错误;
故选B.
点评 本题考查元素的位置、结构及性质的应用,为高频考点,侧重元素的位置及性质的考查,把握位置、性质比较及原子结构为解答的关键,注重了双基训练,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 草酸 | 碳酸 | |
| 一级电离常数(Kad) | 5.9×10-2 | 4.2×10-7 |
| 二级电离常数(Kad) | 6.4×10-3 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XCl | B. | XCl2 | C. | XCl3 | D. | XCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com