
【题目】迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示。则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为

A. 7:6:1 B. 7:6:5 C. 6:7:1 D. 6:7:5
科目:高中化学 来源: 题型:
【题目】(题文)有机物M的合成路线如下图:
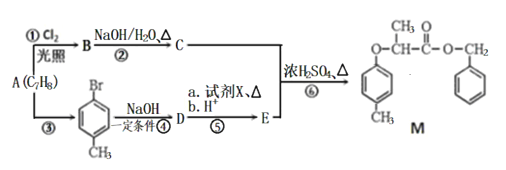
已知:i: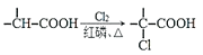 ii:
ii: 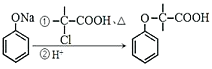
(1)M中含氧官能团的名称有醚键和___________,C的名称为___________,步骤⑥的反应类型为___________。
(2)步骤④反应的化学方程式为_________________________________。
(3)试剂X的结构简式为___________。
(4)同时满足下列条件,E的同分异构体有__________种。
I.能与FeCl3溶液发生显色反应;II.能发生水解反应和银镜反应;III.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1:1:2:2:6的分子的结构简式为: ______________________。
(5)根据以上信息,写出以![]() 为原料制取
为原料制取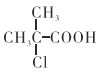 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
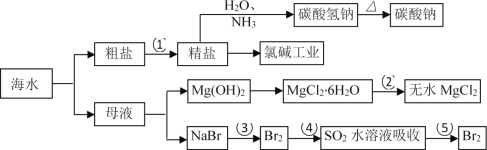
已知:MgCl2 · 6H2O 受热生成 Mg(OH)Cl 和 HCl 气体等。下列有关说法正确的是( )
A. 工业上将石灰水加入到海水中得到 Mg(OH)2 沉淀
B. 在过程②中将 MgCl2 · 6H2O 灼烧即可制得无水 MgCl2
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 制取 NaHCO3 的反应是利用其溶解度小于 NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( ).
A.Fe3+B. MnO4-C.Cl2D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
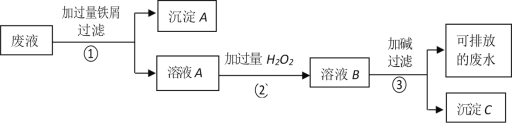
A. 沉淀 A 中含有 2 种金属单质
B. 可用 KSCN 溶液来检验溶液 B 中所含的金属离子
C. 溶液 A 若只经过操作③最终将无法得到沉淀 C
D. 操作①②③中都需要用到玻璃棒、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示可燃物的燃烧热的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
B. CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802 kJ·mol-1
C. CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题。
⑴元素②的单质电子式是_________。
⑵元素⑤与⑥气态氢化物的热稳定性比较(填化学式):_________。
⑶这六种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____。
⑷这六种元素中,能与氧结合,生成物可做耐火材料的是(填元素符号)_________。
⑸在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________; 向上述反应后的溶液中再通入元素⑥的单质,发生反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图5的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
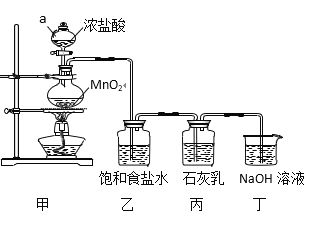
回答下列问题:
(1)甲装置中仪器a的名称是_______,MnO2在反应中所起的作用是(填“氧化剂”或“还原剂”)______________。
(2)装置乙中饱和食盐水的作用是____________________________。
(3)①制取漂白粉的化学方程式是____________________________。
②该小组制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],其主要原因是_________。
③为提高Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com