
分析 已知电池反应Cu+2FeCl3═CuCl2+2FeCl2,反应中Cu失电子为负极,Cu失电子生成铜离子,活泼性比Cu弱的金属或导电的非金属材料为正极,正极上铁离子得电子生成亚铁离子,据此分析.
解答 解:已知电池反应Cu+2FeCl3═CuCl2+2FeCl2,反应中Cu失电子为负极,Cu失电子生成铜离子,负极的电极反应为Cu-2e-═Cu2+;活泼性比Cu弱的金属或导电的非金属材料为正极,如石墨,正极上铁离子得电子生成亚铁离子,正极反应为2Fe3++2e-═2Fe2+;含有铁离子的溶液为电解质溶液,如FeCl3溶液;
故答案为:Cu;Cu-2e-═Cu2+;石墨;2Fe3++2e-═2Fe2+;FeCl3溶液.
点评 本题考查学生原电池的工作原理以及应用知识,注意知识的迁移应用是关键,侧重于考查电极的判断和电极方程式的书写,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

 的化学反应方程式
的化学反应方程式 、
、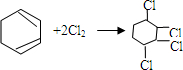 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从左到右,原子半径逐渐减小 | |
| B. | 从左到右,元素原子的得电子能力减弱,失电子能力增强 | |
| C. | 从左到右,气态氢化物的稳定性增强 | |
| D. | 从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.10 mol•L-1氨水加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 将CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| D. | 用0.200 0 mol•L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol•L-1),至中性时,溶液中的酸未被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸溶液中加入氯化钡溶液 | |
| B. | 向硫酸溶液中加入氢氧化钡溶液 | |
| C. | 向氯化钡和氢氧化钠的混合溶液中加入足量硫酸溶液 | |
| D. | 向氢氧化钡溶液加入少量硫酸和盐酸的混合溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com