
用0.1 mol•.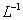 的盐酸滴定0.12 mol•.
的盐酸滴定0.12 mol•.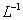 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.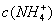 >
>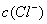 ,
,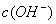 >
>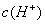 B.
B. 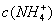 =
=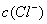 ,
,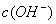 =
=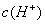
C.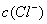 >
>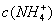 ,
,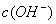 >
>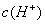 D.
D. 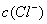 >
>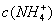 ,
,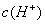 >
>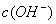
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性溶液中只有Na+、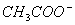 、H+、
、H+、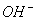 四种离子。则下列描述正确的是( )
四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=2013的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(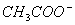 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(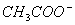 )一定大于c(Na+)、c(NH4+)之和
)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
从铝土矿(主要成分是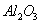 ,含
,含 、
、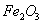 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
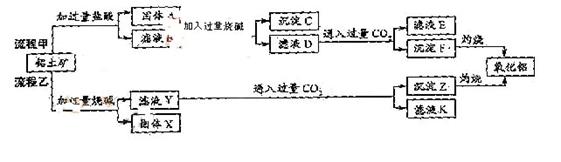
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)流程乙加入烧碱后生成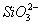 的离子方程式为________.
的离子方程式为________.
(3)验证滤液B含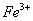 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(5)已知298K时,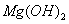 的容度积常数
的容度积常数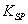 =5.6×
=5.6×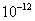 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的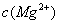 =_______.
=_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
25ºC,若12体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,
该碱的pH与强酸的pH之间该满足的关系是_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/c(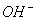 )
)
C. c(H+)和c(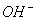 )的乘积 D. OH-的物质的量
)的乘积 D. OH-的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
A. ④①②⑤⑥③ B. ④①②⑥⑤③
C. ①④②⑥③⑤ D. ①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产
硫酸的关键步骤.
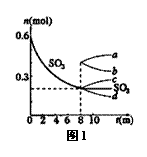 (1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3
物质的量随时间的变化曲线。
①平衡时,SO3的转化率为 (保留小数点后一位) ;
T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
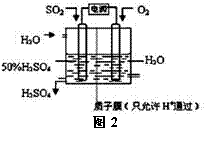 (2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com