
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 mol B. 0.5 mol
C. 0.6 mol D. 0.8 mol
【答案】C
【解析】试题分析:Cu2(OH)2CO3与H2SO4反应的化学方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,生成0.2mol CuSO4和0.3mol H2O,则有0.2mol的CuSO4发生电解反应:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,根据对应关系:CuSO4~2e,转移电子的物质的量为0.4mol,电解0.2mol CuSO4时同时消耗0.2mol H2O,则电解H2O物质的量为0.3mol—0.2mol=0.1mol,2H2O
2Cu+O2↑+2H2SO4,根据对应关系:CuSO4~2e,转移电子的物质的量为0.4mol,电解0.2mol CuSO4时同时消耗0.2mol H2O,则电解H2O物质的量为0.3mol—0.2mol=0.1mol,2H2O![]() 2H2↑+O2↑,对应关系为:H2O~2e,电子转移为0.2mol,所以电解过程中转移的电子的物质的量为:0.4mol+0.2mol=0.6mol,故C项正确。
2H2↑+O2↑,对应关系为:H2O~2e,电子转移为0.2mol,所以电解过程中转移的电子的物质的量为:0.4mol+0.2mol=0.6mol,故C项正确。


科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
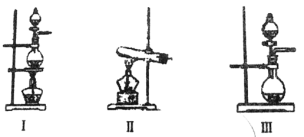
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大,逆反应速率不变。
C.反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①热分解法、②热还原法、③电解法是工业上制取金属的三种常用方法。下列金属与冶炼方法相对应的是( )
选项 | 金属 | 冶炼方法 |
A | K、Na | ③ |
B | Ca、Cu | ② |
C | Fe、Mg | ③ |
D | Al、Hg | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中仪器使用不正确的是( )
A. 容量瓶未经干燥不能用来配制溶液 B. 用铁坩埚灼烧烧碱
C. 中和热的测定实验中用环形玻璃棒搅拌 D. 加热蒸发皿时不用石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
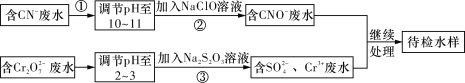
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
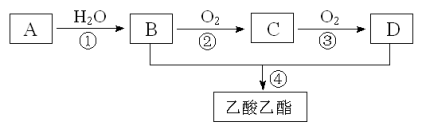
回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,② , 。
(4)写出下列反应的化学方程式:
① ;
② ;
④ 。
(5)已知46gB完全燃烧生成液态水放出热量为1366.8kJ, 写出该反应的热化学方程式______________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com