
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
A. n(Cl2):n(Fe)=5:4 5Cl2+4Fe  2FeCl2+2FeCl3
2FeCl2+2FeCl3
B. n(Cl2):n(FeBr2)=1:1 Fe2++2Br﹣+Cl2═Fe3++Br2+2Cl﹣
C. n(MnO4﹣):n(H2O2)=2:3 2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O
D. n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3﹣═3Fe2++Fe3++3NO↑+6H2O
考点: 离子方程式的书写.
分析: A.铁与氯气反应生成氯化铁,与反应物用量无关;
B.二价铁离子还原性强于溴离子,二者等物质的量反应,二价铁离子全部被氧化,溴离子只氧化一半;
C.n(MnO4﹣):n(H2O2)=2:3,双氧水全部被氧化;
D.n(Fe):n(HNO3(稀))═1:3,反应生成亚铁离子和铁离子.
解答: 解:A.铁与氯气反应生成氯化铁,化学方程式:3Cl2+2Fe  2FeCl3,故A错误;
2FeCl3,故A错误;
B.n(Cl2):n(FeBr2)=1:1,反应的离子方程式:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣,故B错误;
C.n(MnO4﹣):n(H2O2)=2:3,双氧水被氧化成氧气,方程式中一定满足:n(H2O2)=n(O2),正确的离子方程式为:2MnO4﹣+5H2O2+6H+═2Mn2++5O2↑+8H2O,故C错误;
D.n(Fe):n(HNO3(稀))═1:3,反应生成亚铁离子和铁离子,反应的离子方程式为:4Fe+12H++3NO3﹣=3Fe2++Fe3++3NO↑+6H2O,故D正确;
故选:D.
点评: 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度较大.


科目:高中化学 来源: 题型:
下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量
②升高温度
③缩小反应容器的体积
④加入生成物
⑤加入MnO2.
A.全部 B.①②⑤ C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
电解原理在化学工业中有广泛应用.
(1)图1是电解食盐水的工业模拟图
①电解饱和食盐水的离子方程式
②溶液A是
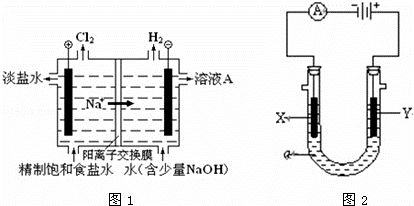
(2)图2是实验室常用的电解池装置,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①在X(填X或Y)极附近观察溶液变红.
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是把
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ,电极反应式是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B. 1 mol Cu和足量稀HNO3反应产生NA个NO分子(NA为阿伏加德罗常数)
C. pH=1的溶液中,Fe2+、NO3﹣、SO42﹣、Na+不能大量共存
D. 三氧化二铁溶于氢碘酸的离子反应为:Fe2O3+6H+=3Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
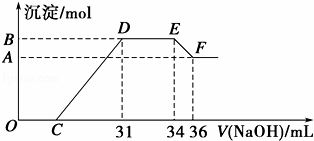
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)请写出该合金中铁与硝酸反应的离子方程式 .
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 .
(4)B与A的差值为 mol.
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释(或结论)都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是
①乙烯的结构简式:CH2CH2 ②明矾的化学式: KAlSO4·12H2O
③ CSO的电子式: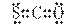 ④铬原于价电子层排布图
④铬原于价电子层排布图
⑤葡萄糖的实验式:CH2O ⑥原子核内有20个中子的氯原子: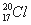
⑦ HCO3-的水解方程式为:HCO3-+H2O CO32-+H3O+ ⑧淀粉的分子式:(C6H10O5)n
CO32-+H3O+ ⑧淀粉的分子式:(C6H10O5)n
⑨对硝基苯酚的结构简式:  ⑩Cl-的结构示意图:
⑩Cl-的结构示意图: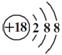
A.③④⑤⑧ B.③⑤⑧ C.③⑤⑧⑨ D.①③⑤⑥⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
HNO3具有很强的氧化性,常温下能氧化金属Cu,反应的化学方程式如下(已配平):
3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑ + 4 H2O
(1)用双线桥法(或单线桥法)表示电子转移的方向和数目。
(2)该反应中,还原产物是________。
(3)HNO3在上述反应中显示出来的性质是 。
A.氧化性 B.还原性 C.酸性 D.碱性
(4)当转移9.03×1023个电子时,生成的NO(标准状况)气体的体积为____________。
(1)用双线桥法(或单线桥法)表示电子转移的方向和数目。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com