
【题目】某化学小组选用酸性高锰酸钾溶液和草酸(H2C2O4)溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录]
已知:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
_mol·L-1H2C2O4溶液 | H2O | 0.05 mol·L-1KMnO4溶液 | 3 mol·L-1稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
请回答:
(1)[实验原理]_____________(写离子方程式)。
(2)为完成实验目的,H2C2O4溶液的物质的量浓度不低于________。
(3)根据上表中的实验数据,可以得到的结论是_________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。

①该小组同学提出的假设是__________。
②请你帮助该小组同学完成实验方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量MnSO4 | 室温下溶液颜色褪至无色所需时间/min | |||
__mol·L-1 H2C2O4溶液 | H2O | 0.05 mol·L-1 KMnO4溶液 | 3 mol·L-1 稀硫酸 | |||
4 | 3.0 | 1.0 | 4.0 | 2.0 | 0.1 g | t |
若该小组同学提出的假设成立,应观察到的现象_____________。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 0.5 mol/L 其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) 与实验1比较,溶液褪色所需时间短[或所用时间(t)小于4.0 min]
【解析】
(1))酸性高锰酸钾溶液既有氧化性,草酸(H2C2O4)具有还原性,二者在溶液中发生氧化还原反应产生Mn2+、CO2及H2O,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)高锰酸钾的物质的量为n(KMnO4)=cV=0.05 mol/L×0.004 L=0.0002 mol,根据方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,可知需要消耗H2C2O4的物质的量至少为n(H2C2O4)=0.0002 mol×![]() =0.0005 mol,在实验③中要保证高锰酸钾完全反应,则需要草酸溶液物质的量浓度至少c(H2C2O4)=
=0.0005 mol,在实验③中要保证高锰酸钾完全反应,则需要草酸溶液物质的量浓度至少c(H2C2O4)=![]() =0.5 mol/L;
=0.5 mol/L;
(3)从表中数据可知改变的条件是H2C2O4溶液的浓度;其他条件相同时,增大H2C2O4溶液的浓度,溶液褪色时间越短,说明反应速率增大;
(4)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则实验1未加硫酸锰,实验4加入了硫酸锰,硫酸锰能够加快反应速率,缩短反应时间,若该小组同学提出的假设成立,由于实验1褪色时间是4 min,则实验实验4溶液褪色的时间小于4 min,从而说明Mn2+是催化剂。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型____(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是____,该反应的类型___。
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
![]()
则反应②的化学方程式为___,该反应的类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s)![]() C(金刚石,s) △H>0,则金刚石比石墨稳定
C(金刚石,s) △H>0,则金刚石比石墨稳定
B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.N2(g)+3H2(g)![]() 2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
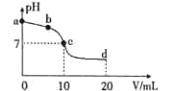
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是( )
A. 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯
B. 用酸性高锰酸钾溶液即可检验CH2=CH-CHO中的碳碳双键
C. 将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
D. 淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是植物秸秆的主要成分,以A为原料在一定条件下可获得多种有机物,它们的相互转化关系如图所示。已知F是一种最简单的烯烃。请回答:

(1)F→C的反应类型是___。
(2)D的官能团名称为___。
(3)C+E→G的化学方程式是___。
(4)下列说法正确的是__。
A.D能被氧化成E,但不能被还原成C
B.实验室制备G时可用浓硫酸作催化剂和吸水剂
C.B、C、E三种物质可以用新制氢氧化铜悬浊液鉴别
D.相同质量的B、G完全燃烧生成水的质量相等
E.SO2气体与F均能使溴水褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出以下物质的电子式:
Na2O2:___;H2S:___;NaHS:___。
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3___H3PO4;稳定性:HCl___CH4;氧化性:Cu2+___Fe3+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
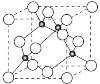
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯
B. 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. 有机物A的分子式为C8H18
D. 有机物A的一氯取代物只有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com