
科目:高中化学 来源: 题型:阅读理解
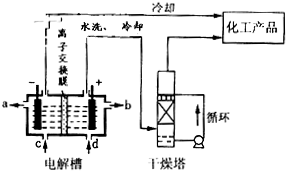
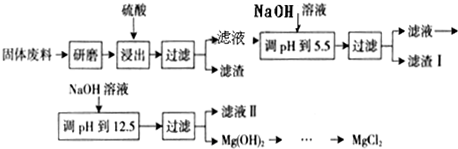
| ||
| ||
| △ |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
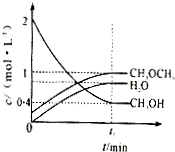 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
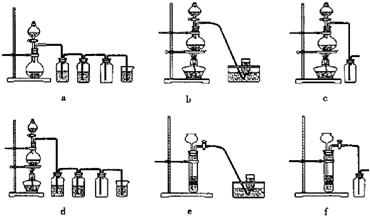
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
已知:CH3COOH+HOCH2CH2CH(CH3)2 CH3COOCH2CH2CH(CH3)2+H2O
|
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2℃ | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78℃ | 140 | 难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的 中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是 ,采用边反应边将其蒸出的方法的目的是 。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是 。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去 杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用 (填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集 ℃的馏分,称重,产物重8.4g,则该实验的产率为 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2011届重庆市重庆一中高三3月月考(理综)化学部分 题型:填空题
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。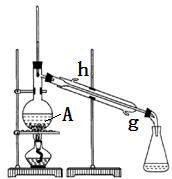
已知:CH3COOH+HOCH2CH2CH(CH3)2  CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
| | 密度(g/m L) L) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2℃ | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78℃ | 140 | 难溶于水 |
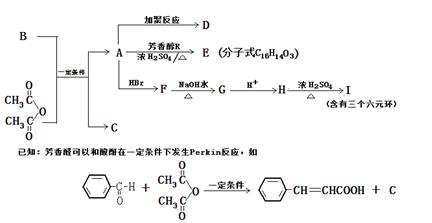
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市高三3月月考(理综)化学部分 题型:填空题
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
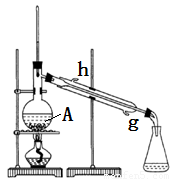
已知:CH3COOH+HOCH2CH2CH(CH3)2
 CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
|
|
密度(g/mL) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
冰醋酸 |
1.049 |
16.6 |
118.1 |
能溶于水 |
|
异戊醇 |
0.812 |
-117.2℃ |
130.5 |
微溶于水 |
|
乙酸异戊酯 |
0.869 |
-78℃ |
140 |
难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的 中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是 ,采用边反应边将其蒸出的方法的目的是 。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是 。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去 杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用 (填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集 ℃的馏分,称重,产物重8.4g,则该实验的产率为 。(保留两位有效数字)
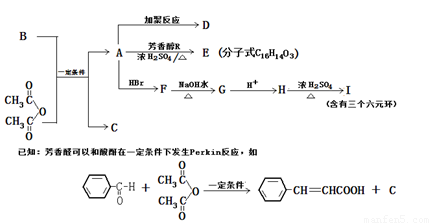
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com