
 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.分析 (1)①根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
②利用假设法分析,假设是强碱,稀释100倍后,溶液的pH减小2个单位,如果是弱碱,稀释100倍后,溶液的pH减小的小于2个单位;
③如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,如果不变化,则证明是强碱;
(2)a、根据电荷守恒,如溶液呈中性,c(H+)=c(OH-),则有c (C1-)=c(NH4+),此时氨水应过量少许;
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-);
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-);
(3)因为NH4++H2O?NH3•H2O+H+,PH=5,$\sqrt{0.1×\frac{{K}_{w}}{{K}_{b}}}$=10-5.
(4)①根据反应物和生成物写出化学方程式;判断出氧化产物和还原产物,计算得到答案;
②据题意,根据通入气体判断两极,书写电极反应式;阴离子向负极移动;根据电池的总反应判断.
解答 解:(1)①如果氨水是强碱,0.10mol•L-1氨水C(H+)=$\frac{1{0}^{-14}}{0.1}$,pH为13,当溶液的pH<13时,NH3.H2O部分电离,为弱电解质,故答案为:<;
②若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即C(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;
故答案为:(a-2)<b<a;
③向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:溶液颜色变浅;
(2)a根据电荷守恒,如溶液呈中性,c(H+)=c(OH-),则有c (C1-)=c(NH4+),此时氨水应过量少许,故a正确;
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-),故b正确;
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故c正确;
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-),故d错误;
故选abc;
(3)因为NH4++H2O?NH3•H2O+H+,pH=5,$\sqrt{0.1×\frac{{K}_{w}}{{K}_{b}}}$=10-5,则Kb=10-5,故答案为:10-5;
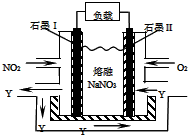
(4)①反应物为NH3和NO,发生氧化还原反应,可得到产物为:N2和H2O,化学方程式为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O;氧化产物和还原产物均为N2,还原产物比氧化产物多0.5mol,即NH3和NO物质的量之差为:1mol,且NH3和NO物质的量之比为4:6,可知NH3和NO物质的量分别为:2mol和3mol,则反应转移电子数为:2mol×3=6mol,故答案为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O;6NA;
②据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,阴离子向负极移动,则NO3-向I极移动,即向左侧移动;电池的正负极的电极方程式相加得到总方程为:O2+4NO2=2N2O5,则放电过程中消耗的NO2和O2的体积比为4:1;
故答案为:NO2+NO3--e-=N2O5;左;4:1.
点评 本题考查较综合,涉及弱电解质的电离、电离平衡移动、离子浓度大小比较、电离常数的计算、氧化还原反应、原原电池原理的应用等,题目难度中等,侧重于考查学生的分析能力、计算能力、以及对基础知识的综合应用能力.


科目:高中化学 来源: 题型:多选题
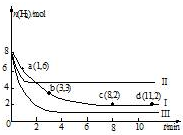 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72L CO | B. | 6.6g CO2 | C. | 8 g SO2 | D. | 9.6g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 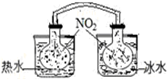 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 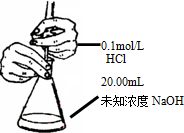 测定锥形瓶内的NaOH的浓度 | |
| C. | 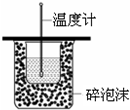 测定中和热 | |
| D. | 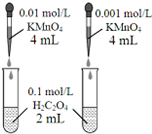 依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
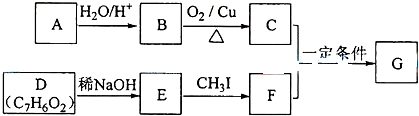
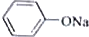 +RCH2I→
+RCH2I→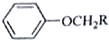
 .
.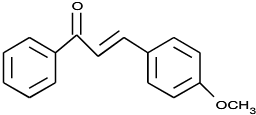 .
.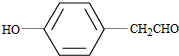 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


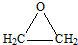 .
.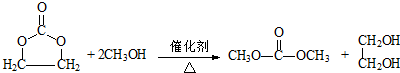 .
.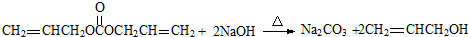 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与溴水发生取代反应 | |
| B. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| C. | 氯乙烷在氢氧化钠的水溶液中生成乙烯 | |
| D. | 将苯、浓HNO3的混合物用水浴加热(60℃左右)制备硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com