
【题目】已知:[CoCl4]2-(蓝色)与[Co(H2O)6]2+(粉红色)之间存在如下平衡:[CoCl4]2-+6H2O [Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。
(1)甲同学向上述溶液中通入HC1,发现溶液变为___色;
(2)乙同学向上述溶液中加水,平衡___(填“向右”、“向左”或“不”)移动。为使平衡保持该移动方向,还可采取的措施有____(写一种)。
科目:高中化学 来源: 题型:
【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
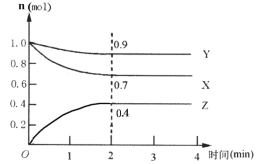
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
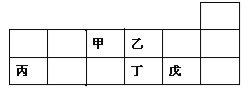
A. 原子半径的大小顺序为:甲>乙>丙>戊
B. 氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C. 元素甲与元素丙的最高正化合价之和的数值等于8
D. 元素戊的氧化物对应的水化物的酸性一定比丁的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol·L-1,0.2 mol·L-1,0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A. c(SO3)=0.4 mol·L-1B. c(SO2)=c(SO3)=0.15 mol·L-1
C. c(O2)=0.1 mol·L-1D. c(SO2)+c(SO3)=0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
A. 1mol NH3所含有的原子数为NA
B. 常温常压下,22.4L氧气所含的原子数为2NA
C. 常温常压下,48g O3所含的氧原子数为3NA
D. 1 L 0.1mol/LNaCl溶液中所含的Na+为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是
A. 1mol![]() 与4mol
与4mol![]() 反应生成的
反应生成的![]() 分子数为
分子数为![]()
B. 1molFe溶于过量硝酸,电子转移数为![]()
C. 14g乙烯和丙烯混合气体中的氢原子数为![]()
D. 标准状况下,2.24L![]() 含有的共价键数为0.4
含有的共价键数为0.4![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com