
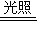 CH3CH2CH2CH2Cl+HCl,该反应为取代反应.
CH3CH2CH2CH2Cl+HCl,该反应为取代反应. CH3CH2CH2CH2Cl+HCl,取代反应.
CH3CH2CH2CH2Cl+HCl,取代反应.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:013
两个原硅酸分子的氢氧原子团之间可以相互作用脱去1分子水,如:![]() .已知原硅酸的结构式为
.已知原硅酸的结构式为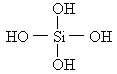 ,则在所得的
,则在所得的![]() 分子中含有的硅氧键数目为
分子中含有的硅氧键数目为
[ ]
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市西城区高三二模试卷(理综)化学部分 题型:填空题
A、B、D、E、Y为5种短周期元素。
①A、B、D位于同一周期,D、Y位于同一主族。A的原子的最外层电子数是其次外层电子数的2倍。
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属。
请回答:
(1)AD2中具有的化学键的类型是 。
(2)高温时,6 gA的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75 kJ,其反应的热化学方程式是 。
(3)D与氢元素可组成含有10个电子的X一,与X一组成元素相同,原予数个数比也相同的分子的电子式是 。
(4)将盛有一定量红棕色气体BD2的4L容器压缩至2L,待气体颜色不再变化时,容器内的压强(填“大于”、“等于”或“小于”) 原来的2倍,原因是 。
(5)E的某种化合物可用作净水时的混凝剂,其原理是(用离子方程式表示) 。
(6)YD2气体通入足量BaCl2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期期中考试理科化学试卷(解析版) 题型:填空题
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com