
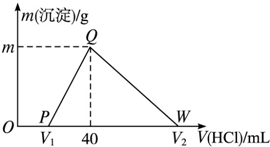
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金质量为0.92g | B. | 图中V2为60 | ||
| C. | 沉淀的质量m为1.56g | D. | OP段发生的反应为:OH-+H+═H2O |
分析 钠铝合金置于水中,合金全部溶解,发生反应:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,得到20mL pH=14的溶液,则溶液中c(OH-)=1mol/L,NaOH有剩余,剩余NaOH为0.02L×1mol/L=0.02mol;
开始加入盐酸没有立即产生沉淀,首先发生反应:NaOH+HCl═NaCl+H2O,该阶段消耗盐酸为$\frac{0.02mol}{1mol/L}$=0.02L=20mL;
然后发生反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl),该阶段消耗盐酸体积为40mL-20mL=20mL,根据方程式计算n[Al(OH)3],根据铝元素守恒n(Al)=n[Al(OH)3];
最后发生反应:Al(OH)3↓+3HCl═AlCl3+3H2O,根据氢氧化铝的物质的量计算该阶段消耗盐酸的体积,
A.根据m=nM计算Na、Al合金的质量;
B.溶解氢氧化铝消耗的盐酸体积与40mL之和为V2的值
C.根据氢氧化铝的物质的量,根据m=nM计算氢氧化铝的质量;
D.OP段发生反应:NaOH+HCl═NaCl+H2O.
解答 解:钠铝合金置于水中,合金全部溶解,发生反应:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,得到20mL pH=14的溶液,则溶液中c(OH-)=1mol/L,NaOH有剩余,剩余NaOH为0.02L×1mol/L=0.02mol;
开始加入盐酸没有立即产生沉淀,首先发生反应:NaOH+HCl═NaCl+H2O,该阶段消耗盐酸为$\frac{0.02mol}{1mol/L}$=0.02L=20mL;
然后发生反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl)=0.04L×1mol/L=0.04mol,该阶段消耗盐酸体积为40mL-20mL=20mL,根据方程式可知n[Al(OH)3]=n(HCl)=0.02L×1mol/L=0.02mol,根据铝元素守恒n(Al)=n[Al(OH)3]=0.02mol,
最后发生反应:Al(OH)3↓+3HCl═AlCl3+3H2O,消耗盐酸的物质的量为0.02mol×3=0.06mol,故该阶段消耗的盐酸体积为$\frac{0.0mol}{1mol/L}$=0.06L=60mL,
A.由上述分析可知,Na、Al合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误;
B.由上述计算可知,溶解氢氧化铝消耗盐酸的体积为60mL,则V2为40mL+60mL=100mL,故B错误;
C.由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故C正确;
D.OP段发生反应:NaOH+HCl═NaCl+H2O,离子方程式为:OH-+H+═H2O,故D正确;
故选CD.
点评 本题考查混合物的有关计算,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,注意利用元素守恒的方法来解答,难度较大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:多选题
| A. | 向某溶液中加入NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入BaCl2溶液,生成白色沉淀,向该沉淀中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,则原溶液中可能含有SO32- | |
| C. | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中一定含有SO42- | |
| D. | 向某溶液中加入2滴黄色K3[Fe(CN)6]溶液,产生蓝色沉淀,则该溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl- | B. | Cu2+、SO42- | C. | Na+、SO42- | D. | Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol O3的质量是16g | B. | 32gO2中含有的氧气分子数为2NA | ||
| C. | 1gH2中含有的电子数为NA | D. | 0.5NA个铜原子的质量为64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO2含有NA个CO2分子 | B. | 0.1NA个H2SO4分子的质量为9.8克 | ||
| C. | 10gCaCO3含有NA个C原子 | D. | 2molCl2含有2NA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 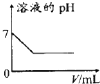 25℃时,向亚硫酸溶液中通入氯气 | B. | 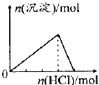 向 Na[Al(OH)4]溶液中通入 HCl气体 | ||
| C. | 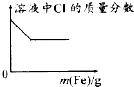 向少量氯化铁溶液中加入铁粉 | D. |  向BaSO4饱和溶液中加入硫酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com