在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)一定温度下,向1L 0.1mol?L
-1 CH
3COOH溶液中加入0.1mol CH
3COONa固体,则溶液中
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
(填“增大”“不变”或“减小”),写出表示该混合溶液中所有离子浓度之间的一个等式
;
(2)土壤的pH一般在4~9之间.土壤中Na
2CO
3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因
,
加入石膏(CaSO
4?2H
2O)可以使土壤碱性降低,有关反应的化学方程式为
;
(3)常温下向20mL 0.1mol?L
-1 Na
2CO
3溶液中逐滴加入0.1mol?L
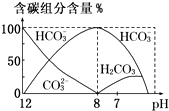
-1 HCl溶液40mL,溶液中含碳元素的各种微粒(CO
2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.
回答下列问题:
①在同一溶液中,H
2CO
3、HCO
3-、CO
32-
(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为
,溶液中各种离子的物质的量浓度的大小关系为
;
③已知在25℃时,CO
32-水解反应的平衡常数即水解常数K
h=
=2×10
-4 mol?L
-1,当溶液中c(HCO
3-):c(CO
32-)=2:1时,溶液的pH=
.

 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.

 名校课堂系列答案
名校课堂系列答案

 可写成
可写成

