
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 100℃时,纯水中c(H +)=1×10-6 mol•L-1,此时纯水显酸性 | |
| C. | 等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,混合后溶液pH>7 | |
| D. | 1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
分析 A.根据c(H+)=10-pH计算两溶液中氢离子浓度之比;
B.溶液酸碱性取决于氢离子与氢氧根离子浓度大小;
C.醋酸为弱酸,混合液中醋酸过量,反应后溶液呈酸性;
D.稀释过程中氢离子浓度减小,由于水的离子积不变,则氢氧根离子浓度增大.
解答 解:A.pH=2的溶液中氢离子浓度为0.01mol/L,pH=1的CH3COOH溶液中c(H+)=0.1mol/L,则两溶液中氢离子浓度之比=0.01mol/L:0.1mol/L=1:10,故A正确;
B.100℃时,纯水中c(H+)=c(OH-)=1×10-6 mol•L-1,此时纯水显中性,故B错误;
C.等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,由于醋酸部分电离出氢离子,则混合液中醋酸过量,混合后溶液呈酸性,溶液的pH<7,故C错误;
D.1mol/L醋酸溶液加水稀释,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子会增大,故D错误;
故选A.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离特点,B为易错点,注意纯水呈中性,试题培养了学生的分析能力及灵活应用能力.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:实验题
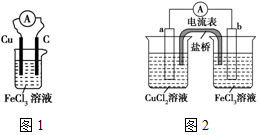 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
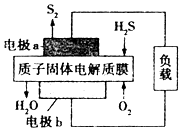 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )| A. | 电池工作时,电子从电极a经质子固体电解质膜流向电极b | |
| B. | 电极a上发生的电极反应为2H2S+4OH--4e-═S2+4H2O | |
| C. | 当电路中通过2 mol电子时,有2 mol H+经质子固体电解质膜进入正极区 | |
| D. | 当反应中生成64 g S2时,电池内部有632KJ的能量转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒 | |
| B. | 中和热测定可以是所有的酸和碱 | |
| C. | 环形玻璃搅拌棒的搅拌方式是上下搅动 | |
| D. | 实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下或在水溶液中能自身电离出自由移动的离子的化合物是电解质 | |
| B. | 凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 某物质若不是电解质,就一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 4:5 | C. | 6:2 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液与NaOH溶液混合 | B. | Al与Fe2O3高温下的铝热反应 | ||
| C. | KMnO4分解制氧气 | D. | Na2CO3在溶液中的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| B. | 过氧化钠可用于呼吸面具作为氧气的来源 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 合金的硬度一般比它的各成分金属的大,熔点一般比它的各成分金属的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com