
【题目】某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
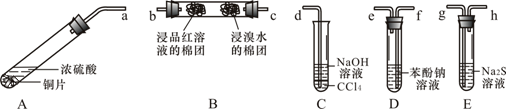
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→ → → → →g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
【答案】(1)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O(2)a f e c b g h d (全对给2分,否则给0分)
CuSO4+SO2↑+2H2O(2)a f e c b g h d (全对给2分,否则给0分)
(3)E试管中溶液变浑浊 SO2+Br2+2H2O=SO42-+2Br-+4H+
(4)吸收未反应完的SO2,以免污染空气 防止溶液倒吸
【解析】
试题分析:铜和浓硫酸在装置A中发生反应制取SO2,反应的化学方程式是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;(2)由于要依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所以应该讲产生的气体先通过D装置。发生反应:SO2+2C6H5ONa+H2O=2C6H5OH↓+Na2SO3,看到在D装置中出现浑浊;证明了SO2具有酸性氧化物的性质,装置中导管连接方法是长进短出;再把从装置D导出的气体通入到B装置中,通过c进入,发生反应:SO2+Br2+2H2O=SO42-+2Br-+4H+,溴单质的元素变浅,证明了SO2具有还原性;在左端遇品红溶液变为无色,又证明了SO2具有漂白性;再把气体导入E 装置,发生反应:SO2+Na2S+2H2O=Na2SO3+H2S;SO2+2H2S=3S↓+2H2O,溶液变浑浊,证明了SO2具有氧化性。由于SO2和H2S都是有毒的气体,会造成大气污染,因此应该用碱溶液进行尾气处理,最后通入C装置,既吸收未反应完的SO2,也防止溶液倒吸。装置导管的连接顺序是a f e c b g h d。
CuSO4+SO2↑+2H2O;(2)由于要依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所以应该讲产生的气体先通过D装置。发生反应:SO2+2C6H5ONa+H2O=2C6H5OH↓+Na2SO3,看到在D装置中出现浑浊;证明了SO2具有酸性氧化物的性质,装置中导管连接方法是长进短出;再把从装置D导出的气体通入到B装置中,通过c进入,发生反应:SO2+Br2+2H2O=SO42-+2Br-+4H+,溴单质的元素变浅,证明了SO2具有还原性;在左端遇品红溶液变为无色,又证明了SO2具有漂白性;再把气体导入E 装置,发生反应:SO2+Na2S+2H2O=Na2SO3+H2S;SO2+2H2S=3S↓+2H2O,溶液变浑浊,证明了SO2具有氧化性。由于SO2和H2S都是有毒的气体,会造成大气污染,因此应该用碱溶液进行尾气处理,最后通入C装置,既吸收未反应完的SO2,也防止溶液倒吸。装置导管的连接顺序是a f e c b g h d。


科目:高中化学 来源: 题型:
【题目】下列物质对应的用途不正确的是( )
A | B | C | D | |
物质 | Fe2O3 | NH3 | Si | Na2O |
用途 | 作红色涂料 | 制硝酸 | 作半导体材料 | 作供氧剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
A. 元素非金属性由强到弱的顺序:Y、X、W
B. W的简单气态氢化物比Y的简单气态氢化物稳定
C. 原子半径由大到小的顺序:Z、Y、X、W
D. WX与ZX中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,错误的是

A. 装置①可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集H2、NH3
D. 利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,A和C分别放入同浓度的稀硫酸中,A的反应速率比C快,A与B和硫酸铜溶液组成原电池时,A的质量增加。A、B、C三种金属的活动性顺序为( )
A. A>B>C B. A>C>B C. B>A>C D. C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
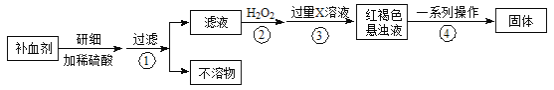
请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+
假设2:只有Fe3+
假设3: 。
(2)如何证明步骤①滤液中含有Fe2+ 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。
①用离子方程式表示该滴定原理:____________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。
重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成下列实验过程的记录表格。(必须填满)
实验编号 | Fe2+溶液的 体积/mL | |||
1 | 20.00 | |||
2 | 20.00 | |||
3 | 20.00 |
③如何判断达到滴定终点:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用来鉴别乙烷和乙烯,还可以用来除去乙烷中乙烯的操作方法是
A.将混合气体通过盛有水的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有硫酸的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择合适的图像
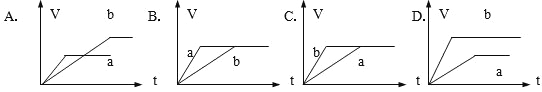
①将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是____________。
②将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是___________。
③将![]() 中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是____________。
中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是____________。
(2)用惰性电极电解400mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后进行如下操作。
①如果向所得的溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
②如果向所得的溶液中加入0.1molCu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
③如果向所得的溶液中加入0.1molCu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com