
 .该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
.该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟. 分析 B既是蛋白质的重要组成成分,也是某种化肥的组成成分,则B为N元素;C为金属元素,焰色反应呈黄色,则C为Na元素;A、B的原子序数之和是元素D的一半,且D的原子序数小于18,则A只能为H元素,D的原子序数为:2(1+7)=16,则D为S元素;E能够形成化合物的短周期元素,其原子序数大于S,所以E为Cl元素,据此结合元素周期律知识进行解答.
解答 解:B既是蛋白质的重要组成成分,也是某种化肥的组成成分,则B为N元素;C为金属元素,焰色反应呈黄色,则C为Na元素;A、B的原子序数之和是元素D的一半,且D的原子序数小于18,则A只能为H元素,D的原子序数为:2(1+7)=16,则D为S元素;E能够形成化合物的短周期元素,其原子序数大于S,所以E为Cl元素,
(1)E为Cl元素,原子序数为17,位于周期表中第三周期第ⅤⅡA族,
故答案为:第三周期第ⅤⅡA族;
(2)B为N元素,D为S元素,形成的化合物中,S的质量分数约为70%,则N的质量分数为30%,则S和N原子个数比为:$\frac{70%}{32}$:$\frac{30%}{14}$=1:1,其相对分子质量在170~190之间,设化学式为(SN)x,则170<46x<190,则x只能为4,所以二者形成的化合物的分子式为:S4N4,
故答案为:S4N4;
(3)B4A4为N4H4,N4H4电离生成两种离子,其中一种为10电子的NH4+,依据N元素与H元素守恒得知另外一种离子应为N3-,该电离方程式为:N4H4=NH4++N3-,
故答案为:N4H4=NH4++N3-;
(4)C2D为Na2S,Na2S溶液在空气中长期放置,与氧气反应会生成Na2S2,则Na2S溶液在空气中变质过程的化学方程式为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为:4Na2S+O2+2H2O═4NaOH+2Na2S2;
(5)D、E两元素分别为S和Cl,按原子个数比1:1组成化合物丁且各原子均满足8电子的稳定结构,其化学式为S2Cl2,其电子式为 ;S2Cl2遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,则X为二氧化硫;Y在标准状态下的密度为1.63g/L,Y的摩尔质量为:1.63g/L×22.4L/mol=36.5,则Y为HCl,根据化合价变化可知,单质为S,
;S2Cl2遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,则X为二氧化硫;Y在标准状态下的密度为1.63g/L,Y的摩尔质量为:1.63g/L×22.4L/mol=36.5,则Y为HCl,根据化合价变化可知,单质为S,
该混合气体相对于H2的密度为21,混合气体的平均相对分子质量为:2×21=42,
设混合气体中二氧化硫的物质的量为x,HCl为的物质的量为y,则:$\frac{64x+36.5y}{x+y}$=42,整理可得:x:y=1:4,根据质量守恒定律可知则该反应的化学方程式为:2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓;
为确定干燥的SO2和HCl混合气体中HCl的存在,由于SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟,所以可把干燥的SO2和HCl与干燥的NH3混合,出现白烟,则证明有HCl气体,故该检验方法正确,
故答案为: ;2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓;正确;SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
;2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓;正确;SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,特点各元素为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及综合应用所学知识的能力,(5)为难点、易错点,需要根据X、Y的性质推断二者组成,然后结合质量守恒定律写出反应的方程式.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
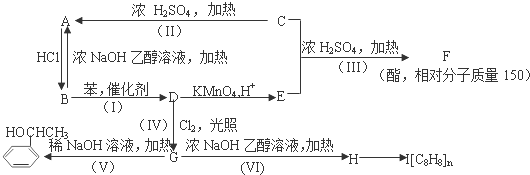
 ;I
;I .
. .
. .
.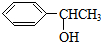 的同分异构体甚多,其中属于酚的同分异构体共有9种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为:
的同分异构体甚多,其中属于酚的同分异构体共有9种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: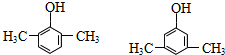 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
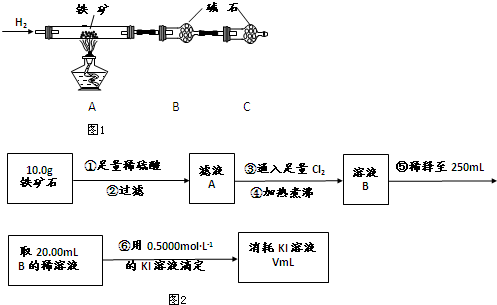
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 | B. | 770 | C. | 290 | D. | 292 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀HNO3 | B. | CO | C. | CH3CH2CH2OH | D. | 稀H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com