
”¾ĢāÄæ”æŅŃÖŖA”¢B”¢C”¢D¶¼ŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×Ó°ė¾¶D£¾C£¾A£¾B”£ŅŃÖŖA”¢BĶ¬ÖÜĘŚ£¬A”¢CĶ¬Ö÷×壬CŌ×ÓŗĖÄŚµÄÖŹ×ÓŹżµČÓŚA”¢BŌ×ÓŗĖÄŚµÄÖŹ×ÓŹżÖ®ŗĶ£¬CŌ×Ó×īĶā²ćµē×ÓŹżŹĒDŌ×Ó×īĶā²ćµē×ÓŹżµÄ3±¶”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)AŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ£ŗ__________£»B”¢DĮ½ŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½£ŗ______”£
(2)ŌŖĖŲB”¢C”¢DµÄ¼ņµ„Ąė×Ó°ė¾¶µÄ“óŠ”Ė³Šņ£ŗ________£ØÓĆĄė×Ó·ūŗÅ»Ų“š£©”£
(3)C”¢DĮ½ŌŖĖŲ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌĒæČõ¹ŲĻµ£ŗ_____£¾______£ØÓĆ»ÆѧŹ½±ķŹ¾£©”£
(4)B”¢CŠĪ³ÉµÄ»ÆŗĻĪļÓėDµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______”£
(5)CµÄµ„ÖŹŌŚDµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄČÜŅŗÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________”£
”¾“š°ø”æ µŚ2ÖÜĘŚ¢óA×å ![]()
![]() O2- > Na+ >Al3+ NaOH >Al(OH)3 Al2O3+2NaOH£½2NaAlO2 + H2O 2Al+2OH- +2H2O£½2AlO2- + 3H2”ü
O2- > Na+ >Al3+ NaOH >Al(OH)3 Al2O3+2NaOH£½2NaAlO2 + H2O 2Al+2OH- +2H2O£½2AlO2- + 3H2”ü
”¾½āĪö”æÓÉA”¢CĶ¬Ö÷×壬Ō×Ó°ė¾¶C£¾A£¬ŌņA”¢Cµē×ÓŹżĻą²ī8£¬CŌ×ÓŗĖÄŚµÄÖŹ×ÓŹżµČÓŚA”¢BŌ×ÓŗĖÄŚµÄÖŹ×ÓŹżÖ®ŗĶ£¬ĶĘ³öBŌ×ÓµÄÖŹ×ÓŹżĪŖ8£¬¼“BĪŖOŌŖĖŲ£¬CĪŖµŚČżÖÜĘŚŌŖĖŲ£¬ÓÉCŌ×Ó×īĶā²ćµē×ÓŹżŹĒDŌ×Ó×īĶā²ćµē×ÓŹżµÄ3±¶£¬ČōD×īĶā²ćĪŖ1øöµē×Ó£¬ŌņC×īĶā²ćĪŖ3øöµē×Ó£¬ČōD×īĶā²ćŹĒ2øöµē×Ó£¬ŌņC×īĶā²ćŹĒ6øöµē×Ó£¬ŌņCÓėBŹĒĶ¬Ö÷×åŌŖĖŲĮĖ£¬²»·ūŗĻĢāŅā£¬¹ŹCĪŖAlŌŖĖŲ£¬DĪŖNaŌŖĖŲ£¬AĪŖBŌŖĖŲ”£
(1)BŌŖĖŲĪŖ5ŗÅŌŖĖŲ£¬ŌŚÖÜĘŚ±ķÖŠĪ»ÓŚµŚ2ÖÜĘŚ¢óA×壻B”¢DĮ½ŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļĪŖŃõ»ÆÄĘ»ņ¹żŃõ»ÆÄĘ£¬µē×ÓŹ½ĪŖ![]() »ņ
»ņ![]() £¬¹Ź“š°øĪŖ£ŗµŚ2ÖÜĘŚ¢óA×壻
£¬¹Ź“š°øĪŖ£ŗµŚ2ÖÜĘŚ¢óA×壻![]() »ņ
»ņ![]() £»
£»
(2) B”¢C”¢DČżÖÖŌŖĖŲµÄ¼ņµ„Ąė×Ó·Ö±šĪŖO2-”¢Al3+”¢Na+£¬ČżÖÖĄė×ÓŗĖĶāµē×ÓÅŲ¼ĻąĶ¬£¬ŗĖµēŗĖŹżŌ½“ó£¬Ąė×Ó°ė¾¶Ō½Š”£¬ŌņÓŠO2-£¾Na+£¾Al3+£¬¹Ź“š°øĪŖ£ŗO2- > Na+ >Al3+£»
(3)ÄĘµÄ½šŹōŠŌ±ČĀĮĒ棬×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌNaOH >Al(OH)3£¬¹Ź“š°øĪŖ£ŗNaOH £»Al(OH)3£»
(4) Al2O3ĪŖĮ½ŠŌŃõ»ÆĪļ£¬ÄÜÓėNaOHČÜŅŗ·“Ó¦£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖAl2O3+2NaOH£½2NaAlO2 + H2O£¬¹Ź“š°øĪŖ£ŗAl2O3+2NaOH£½2NaAlO2 + H2O£»
(5)ĀĮÓėĒāŃõ»ÆÄĘČÜŅŗÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Al+2OH- +2H2O£½2AlO2- + 3H2”ü£¬¹Ź“š°øĪŖ£ŗ2Al+2OH- +2H2O£½2AlO2- + 3H2”ü”£


 ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŃõ»ÆĪļÖŠ£¬ÄÜÓėĖ®·“Ӧɜ³ÉĖįµÄŹĒ£Ø £©
A.SiO2
B.NO
C.Al2O3
D.SO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬E(g)+F(g)![]() R(g)+N(g)µÄĘ½ŗā³£ŹżK=4/9”£øĆĪĀ¶ČĻĀŌŚA”¢B”¢CČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėE(g)”¢F(g)£¬ĘäĘšŹ¼ÅضČČēĻĀ±ķ£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ( )
R(g)+N(g)µÄĘ½ŗā³£ŹżK=4/9”£øĆĪĀ¶ČĻĀŌŚA”¢B”¢CČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėE(g)”¢F(g)£¬ĘäĘšŹ¼ÅضČČēĻĀ±ķ£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ( )
ĘšŹ¼ÅØ¶Č | A | B | C |
c (E)/ molL-1 | 0.010 | 0.020 | 0.020 |
c (F)/ molL-1 | 0.010 | 0.010 | 0.020 |
A. Ę½ŗāŹ±£¬BÖŠEµÄ×Ŗ»ÆĀŹĪŖ“óÓŚ40%
B. Ę½ŗāŹ±£¬AÖŠŗĶCÖŠFµÄ×Ŗ»ÆĀŹ¾łĪŖ40%
C. Ę½ŗāŹ±£¬CÖŠc(R)ŹĒAÖŠµÄ2±¶£¬ĪŖ0.012molL-1
D. ·“Ó¦æŖŹ¼Ź±AŗĶCÖŠ·“Ó¦ĖŁĀŹĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ101kPa£¬ČĪŗĪĪĀ¶ČĻĀ£¬¶¼²»æÉÄÜ×Ō·¢½ųŠŠµÄ·“Ó¦ŹĒ( )
A. N2 (g) + 3H2 (g)![]() 2NH3 (g) ¦¤H <0
2NH3 (g) ¦¤H <0
B. CaCO3(g)![]() CaO (s) + CO2 (g) ¦¤H >0
CaO (s) + CO2 (g) ¦¤H >0
C. 2CO (g)![]() 2C (s) + O2 (g) ¦¤H >0
2C (s) + O2 (g) ¦¤H >0
D. 4NH3 (g) + 5O2 (g)![]() 4NO (g) + 6H2O (g) ¦¤H <0
4NO (g) + 6H2O (g) ¦¤H <0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒóĶź³ÉĻĀĮŠĪŹĢā£ŗ
(1)ĒėÓĆĻµĶ³ĆüĆū·ØøųĻĀĮŠÓŠ»śĪļÓčŅŌĆüĆū£ŗ
¢Ł ________________ ¢Ś
________________ ¢Ś ___________________
___________________
£Ø2£©Ļą¶Ō·Ö×ÓÖŹĮæĪŖ72ĒŅ·Šµć×īµĶµÄĶéĢžµÄ½į¹¹¼ņŹ½____________
£Ø3£©ÓėH2¼Ó³ÉÉś³É2£¬5©¶ž¼×»ł¼ŗĶéµÄČ²ĢžµÄĻµĶ³ĆüĆū_________________
£Ø4£©![]() µÄĻµĶ³ĆüĆū__________________________£®
µÄĻµĶ³ĆüĆū__________________________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫×ćĮæĢś·ŪĶ¶ČėŅ»¶ØÅØ¶ČµÄĀČ»ÆĢśŗĶĀČ»ÆĶµÄ»ģŗĻČÜŅŗÖŠ£¬³ä·Ö·“Ó¦ŗó£¬ČÜŅŗÖŠŹ£Óą¹ĢĢåµÄÖŹĮæÓė¼ÓČėĢś·ŪµÄÖŹĮæĻąĶ¬£¬ŌņŌČÜŅŗÖŠĀČ»ÆĢśŗĶĀČ»ÆĶµÄÅضČÖ®±ČĪŖ£Ø £©
A.2£ŗ7
B.3£ŗ4
C.4£ŗ7
D.2£ŗ3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬ŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČėŅ»¶ØĮæµÄAÓėB·¢Éś·“Ó¦£ŗA(s)+2B(g) ![]() C(g)+2D(g) ”÷H<0£¬Ę½ŗāŹ±CµÄĪļÖŹµÄĮæÓė¼ÓČėBµÄĪļÖŹµÄĮæµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ŗ
C(g)+2D(g) ”÷H<0£¬Ę½ŗāŹ±CµÄĪļÖŹµÄĮæÓė¼ÓČėBµÄĪļÖŹµÄĮæµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ŗ
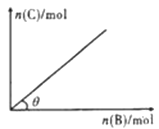
A. Ōö¼ÓAµÄĪļÖŹµÄĮæ£¬Õż·“Ó¦ĖŁĀŹ¼Óæģ
B. Ę½ŗāŹ±£¬ĘäĖūĢõ¼ž²»±ä£¬µ±ĪĀ¶ČÉżøߏ±£¬×Ŗ»ÆĀŹ±ä“ó
C. Ķ¼ÖŠĒśĻߵĊ±ĀŹ±ķŹ¾·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż
D. Ę½ŗāŹ±£¬ĘäĖūĢõ¼ž²»±ä£¬ŌŁĶØČĖB£¬Ōņ·“Ó¦»ģŗĻĪļµÄĪĀ¶ČÉżøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼Ó³É·“Ó¦Ņ²ŹĒÓŠ»ś»Æѧ֊µÄŅ»ĄąÖŲŅŖµÄ·“Ó¦ĄąŠĶ£¬ĻĀĮŠĪļÖŹø÷×éĪļÖŹÖŠ²»ÄÜČ«²æ·¢Éś¼Ó³É·“Ó¦µÄŹĒ £Ø £©
A. ŅŅĶ锢ŅŅĻ© B. ŅŅĻ©”¢ŅŅČ² C. ĀČŅŅĻ©”¢äåŅŅĻ© D. ±½”¢2£¶”Ļ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ģå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗN2(g)£«3H2(g)![]() 2NH3(g)£¬ĘšŹ¼Ź±£¬³äČėµÄN2ŗĶH2µÄĪļÖŹµÄĮæ·Ö±šŹĒ3.0 molŗĶ6.0 mol£¬3minŗó“ļµ½Ę½ŗā£¬Éś³ÉNH3µÄĪļÖŹµÄĮæŹĒ2.4 mol”£ŹŌĒó£ŗ
2NH3(g)£¬ĘšŹ¼Ź±£¬³äČėµÄN2ŗĶH2µÄĪļÖŹµÄĮæ·Ö±šŹĒ3.0 molŗĶ6.0 mol£¬3minŗó“ļµ½Ę½ŗā£¬Éś³ÉNH3µÄĪļÖŹµÄĮæŹĒ2.4 mol”£ŹŌĒó£ŗ
¢Ł 3minÄŚÓĆN2±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ____________”£¢ŚH2µÄ×Ŗ»ÆĀŹŹĒ____________”£
(2)ij»ÆѧŹµŃ銔×éµÄĶ¬Ń§ĪŖĢ½¾æŗĶ±Č½ĻSO2ŗĶĀČĖ®µÄĘư׊Ō£¬Éč¼ĘĮĖČēĻĀµÄŹµŃé×°ÖĆ”£
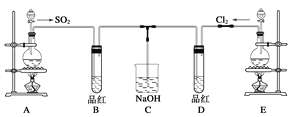
a.ŹµŃéŹŅÓĆ×°ÖĆEÖʱøCl2£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2£«4HCl(ÅØ)![]() MnCl2£«Cl2£«2H2O”£ČōÓŠ6 mol µÄHCl²Ī¼Ó·“Ó¦£¬Ōņ×ŖŅʵĵē×ÓĪļÖŹµÄĮæĪŖ____________£»
MnCl2£«Cl2£«2H2O”£ČōÓŠ6 mol µÄHCl²Ī¼Ó·“Ó¦£¬Ōņ×ŖŅʵĵē×ÓĪļÖŹµÄĮæĪŖ____________£»
b.¢Ł·“Ó¦æŖŹ¼Ņ»¶ĪŹ±¼äŗ󣬹Ū²ģµ½DŹŌ¹ÜÖŠµÄĘ·ŗģČÜŅŗ³öĻÖµÄĻÖĻóŹĒ£ŗ
D£ŗ_____________________________________________________________”£
¢ŚĶ£Ö¹ĶØĘųŗó£¬ŌŁøųB”¢DĮ½øöŹŌ¹Ü·Ö±š¼ÓČČ£»Į½øöŹŌ¹ÜÖŠµÄĻÖĻó·Ö±šĪŖ£ŗ
B£ŗ____________________________________£¬D£ŗ________________________________”£
c.ĮķŅ»øöŹµŃ銔×éµÄĶ¬Ń§ČĻĪŖSO2ŗĶĀČĖ®¶¼ÓŠĘư׊Ō£¬¶žÕß»ģŗĻŗóµÄĘư׊ŌæĻ¶Ø»įøüĒ攣ĖūĆĒ½«ÖʵƵÄSO2ŗĶCl2°“1”Ć1Ķ¬Ź±ĶØČėµ½Ę·ŗģČÜŅŗÖŠ£¬½į¹ū·¢ĻÖĶŹÉ«Š§¹ū²¢²»ĻńĻėĻóµÄÄĒŃł”£ĒėÄć·ÖĪöøĆĻÖĻóµÄŌŅņ(ÓĆ»Æѧ·½³ĢŹ½±ķŹ¾)_______________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com