
| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 若A和C形成一种化合物CA,则CA属于离子化合物 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | 由于化合物A2B形成氢键,所以热稳定性:A2B>A2D | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(Fe)=0.5mol•(L•min)-1 | B. | v(H2SO4)=1mol•(L•min)-1 | ||
| C. | v(H2)=0.5mol•(L•min)-1 | D. | v=(FeSO4)=0.5mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管滴至终点对,俯视读数 | |
| B. | 锥形瓶用蒸馏水洗后,未干燥 | |
| C. | 酸式滴定管用蒸馏水洗后,未用标准液润洗 | |
| D. | 酸式滴定管滴定至终点后,发现尖嘴处有气泡(原来无气泡) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
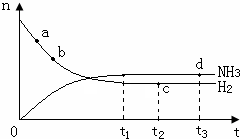 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com