
【题目】A、B、C三种元素在周期表中的位置如下图所示,已知A、B、C原子序数之和为37。下列关于A、B、C三种元素的说法正确的是
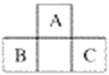
A. 元素B和C位于第四周期 B. 元素A的原子序数为7
C. 元素B最外层有5个电子 D. 元素C位于第三周期ⅤA族
【答案】B
【解析】
若位于短周期或元素周期表的左侧时,设A的原子序数为x,结合位置可知,B的原子序数为x+7,C的原子序数为x+9,A、B、C原子序数之和为37,则x+x+7+x+9=37,解得x=7,则A为N,B为Si,C为S;若位于长周期时,设A的原子序数为x,结合位置可知,B的原子序数为x+17,C的原子序数为x+19,A、B、C原子序数之和为37,则x+x+17+x+19=37,解得x=1/3不符合题意。故A为N,B为Si,C为S。
A、元素B为Si,C为S,位于第三周期,故A错误;B、元素A为N,原子序数为7,故B正确;C、元素B为Si,最外层有4个电子,故C错误;D、元素C为S,第三周期ⅥA族,故D错误;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钴(Co)的氧化物是一种重要的化工原料,工业上利用反应CoCO3+O2![]() CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
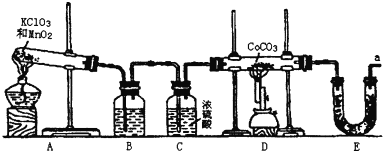
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式___;
(2)E装置的U形管里盛放的物质是___;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是___;
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起___;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为___;请写出详细的计算过程。
(6)此实验装置存在一个比较大的缺陷,如何完善___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
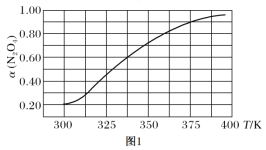
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
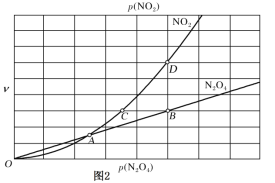
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量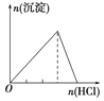
B.向 AlCl3 溶液中逐滴 滴加氨水至过量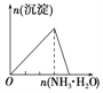
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量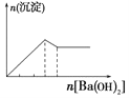
D.向澄清石灰水中缓缓 通入 CO2 至过量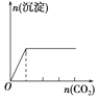
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
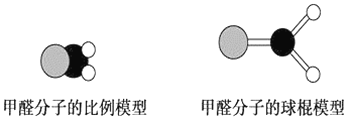
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:
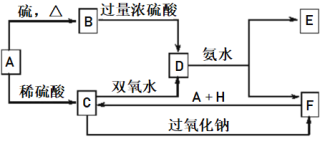
已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com