
 的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是
的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是 .
.
分析 (1)乙烯和氯气发生加成反应,甲烷和氯气发生取代反应;
(2)CH2═CHCl含有碳碳双键,可发生加聚反应生成聚氯乙烯,聚苯乙烯的单体为苯乙烯;
(3)二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,以此解答该题.
解答 解:(1)①因为CH2=CH2也可以与Cl2发生加成反应,而使黄绿色逐渐褪色,生成的CH2ClCH2Cl也是油状液体,则不能确定是否含有甲烷,
故答案为:不正确,因为CH2=CH2也可以与Cl2发生加成反应,而使黄绿色逐渐褪色,生成的CH2ClCH2Cl也是油状液体;
②乙烯和氯气发生加成反应,甲烷和氯气发生取代反应,故答案为:取代反应、加成反应;
(2)由氯乙烯合成聚氯乙烯的反应为: ,
,
故答案为: ;
;
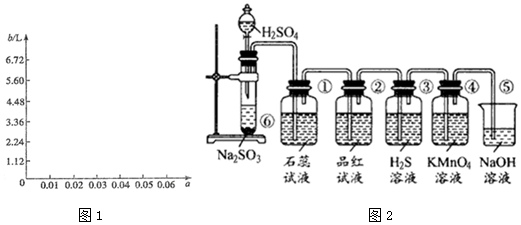
(3)装置①中盛有品红溶液,用来检验二氧化硫的存在;然后将气体通入盛有氢氧化钠溶液的②除去二氧化硫,再通入盛有品红溶液的③确定二氧化硫是否除干净,最后通入盛有酸性高锰酸钾的④检验乙烯的存在;装置③中的品红溶液不退色可以排除二氧化硫的干扰,若装置④中的酸性KMnO4溶液退色,可证明乙烯的存在,若将酸性高锰酸钾溶液换成溴 水,溴水与乙烯发生加成反应,方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:A;B;A;D;③中品红溶液不褪色,④中酸性高锰酸钾溶液褪色;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题考查物质的性质实验,为高考常见题型,侧重于学生的分析、实验能力的考查,题目着重考查了乙烯的实验室制法以及产物的检验,熟悉二氧化硫、乙烯的性质是解题关键,注意实验设计的严密性,气体检验的顺序,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.98 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,COS属于极性分子(填“极性”或“非极性”).
,COS属于极性分子(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | .氯化钠的水溶液能够导电 | B. | .氯化钠晶体中只存在离子键 | ||
| C. | .熔融的氯化钠可以导电 | D. | 氯化钠的熔沸点比较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Fe3+、NO3-、SO42- | ||
| C. | Ca2+、H+、C1-、OH- | D. | Na+、Ba2+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| B. | 用瓷坩埚加热熔化氢氧化钠固体 | |
| C. | 向BaCl2溶液中通入SO2,溶液不变浑浊,再入CO2,溶液仍不变浑浊 | |
| D. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com