
| A. | 加入醋酸钠固体 | B. | 加入盐酸 | C. | 加入蒸馏水 | D. | 升高温度 |
分析 CH3COOH?CH3COO-+H+,要使电离平衡右移且溶液中c(OH-)增大,则不能增大CH3COO-、H+的浓度,且电离为吸热反应,以此来解答.
解答 解:A.加入醋酸钠固体,CH3COO-的浓度增大,平衡向左移动,故A不选;
B.加入盐酸,H+的浓度增大,平衡向左移动,故B不选;
C.加入蒸馏水,促进电离,平衡右移且溶液中c(H+)减小,由Kw不变可知c(OH-)增大,故C选;
D.电离为吸热反应,则升高温度,平衡右移且溶液中c(H+)增大,故D不选;
故选C.
点评 本题考查弱电解质的电离平衡,为高频考点,把握影响电离平衡的因素为解答的关键,侧重分析与应用能力的考查,注意加水与升高温度均促进弱电解质的电离,题目难度不大.


科目:高中化学 来源: 题型:实验题
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
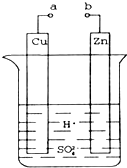 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑦ | C. | ③⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
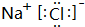 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
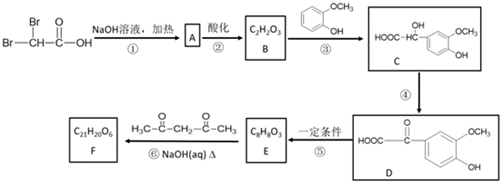
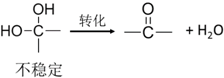

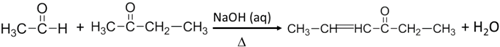
 .反应④的化学方程式是
.反应④的化学方程式是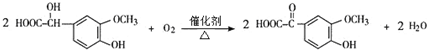 .
.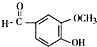 .F的结构简式是
.F的结构简式是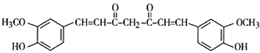 .
.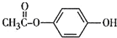 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
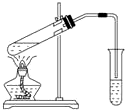 下列实验能获得成功的是( )
下列实验能获得成功的是( )| A. | 用如图所示装置,无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 | |
| C. | 水和乙醇的混合液,可用蒸馏的方法使其分离 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可观察到有银镜出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com