
 为
为 科目:高中化学 来源:不详 题型:单选题
| A.一定有 CO32- | B.一定有Ag+ | C.一定有SO42- | D.无法肯定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

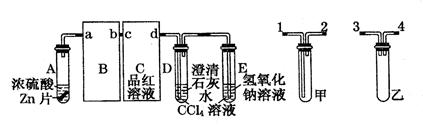
 。
。 量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。
量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
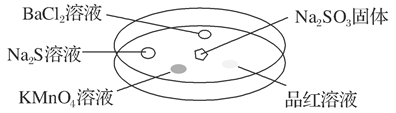
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯净水几乎不含任何杂质,喝纯净水比喝矿泉水对人体更有营养 |
| B.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| C.雨水样品一段时间后,pH由4.68变为4.28,是因为雨水中溶解了较多的氮氧化物和CO2 |
| D.二氧化硫的大量排放是造成酸雨和光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为BaSO4 | B.反应后溶液的pH减小 |
| C.此实验表明SO2有漂白性 | D.此实验中Fe3+表现出氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n =" 2" | B.SCln中每个原子最外层均满足8电子稳定结构 |
| C.SCln在固态时为分子晶体 | D.SCln溶于水能电离出Cl-- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

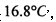 沸点是
沸点是 )
)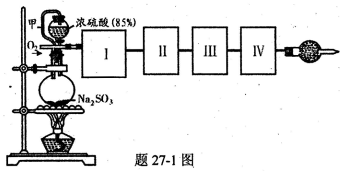
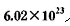 个电子转移,则该反应的化学方程式为__________________
个电子转移,则该反应的化学方程式为__________________ 粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2 —段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为__________________.(用含m、n的代数式填写)
粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2 —段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为__________________.(用含m、n的代数式填写)查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com