
下列事实中,能够证明HCl是共价化合物的是( )
A.HCl易溶于水 B.液态的HCl不导电
C.HCl不易分解 D.HCl溶于水能电离,呈酸性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山东省高一6月月考化学试卷(解析版) 题型:填空题
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
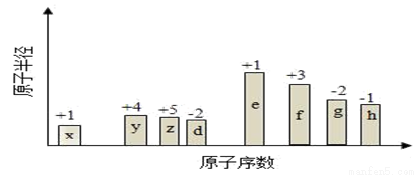
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)写出x与z形成四原子共价化合物的电子式__________。
(4)物质A是一种比水轻的油状液体,仅由x、y两种元素组成,y元素与x元素的质量比为12:1,A的相对分子质量为78.A与浓硫酸与浓硝酸在50-60℃反应的化学反应方程式______,反应类型______.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下学期六月月考化学试卷(解析版) 题型:选择题
向ZnSO4和CuCl2的混合溶液中加入过量的铁粉,充分反应后,过滤、洗涤、干燥得到滤渣,该滤渣中含有的金属是( )
A.Zn、Fe B.Zn、Cu C.Fe、Cu D.Zn、Fe、Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高一下4月月考化学试卷(解析版) 题型:选择题
两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为:①m﹣4 ②m+4 ③m+8 ④m﹣2 ⑤m+7( )
A. ①②④⑤ B. ①②③⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高一下4月月考化学试卷(解析版) 题型:选择题
A、B、C、D四种元素,其离子A+、B2+、C﹣、D2﹣具有相同的电子层结构,下列判断正确的是( )
A.原子序数由大到小的顺序是:B>A>C>D
B.离子半径由大到小的顺序是:B2+>A+>C﹣>D2﹣
C.A、B、C、D四种元素可能属于同一周期
D.ABCD四种元素一定属于短周期元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:填空题
原子序数小于20的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W形成的常见单质既能与强酸反应,又能与强碱反应.回答下列问题:
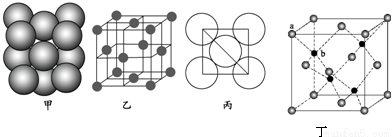
(1)Y2X4分子中Y原子轨道的杂化类型为 ,1mol Y2X4含有σ键的数目为 .
(2)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 .
(3)化合物ZX3在水中的溶解度比化合物YX4大得多,其主要原因是 .
(4)请写出W单质和强碱溶液反应的离子方程式 ,W单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.晶胞中铝原子的配位数为 ,若已知W的原子半径为d,NA代表阿伏加德罗常数,W的相对原子质量为M,该晶体的密度为 (用字母表示).
(5)立方ZnS晶胞结构如图丁所示:,立方体的顶点和面心位置为Zn2+,则Zn2+的配位数为 ,若其晶胞边长为a pm,a位置Zn2+与b位置S2﹣之间的距离为 pm(列式表示).
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:选择题
下列说法中错误的是:( )
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:填空题
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
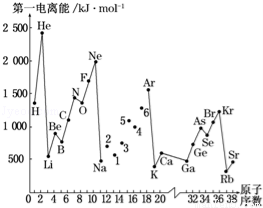
请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从如图分析可知,同一主族元素原子的第一电离能I1的变化规律是 .
(3)N元素的第一电离能比C、O元素的第一电离能大的原因是: .
(4)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519kJ•mol﹣1,失去第二个电子为7 296kJ•mol﹣1,失去第三个电子为11 799kJ•mol﹣1,由此数据分析为何锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:选择题
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
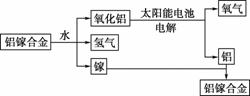
A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水反应的化学方程式为2Al+3H2O=Al2O3+3H2↑
D.总反应式为2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com