
| |||||||||||||||||||||||||
 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ����Ϊ��������һ�ָ�Ч������Ⱦ��������Դ��Ϊ����CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2��
��ѧ����Ϊ��������һ�ָ�Ч������Ⱦ��������Դ��Ϊ����CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ����12��������⻯ѧ�Ծ��������棩 ���ͣ������
��15�֣���ѧ����Ϊ��������һ�ָ�Ч������Ⱦ��������Դ����20����������������Ϊδ���Ķ���ȼ������Դ���о������Ѹ�ٷ�չ��
��1��Ϊ����Ч��չ��������Դ�����ȱ����Ƶ����۵����������пɹ������ֽϾ�������Դ�ɳ������õ��������ķ����� ����ѡ����ĸ��
A�����ˮ B��п��ϡ���ᷴӦ
C����⺣ˮ D���ֽ���Ȼ��
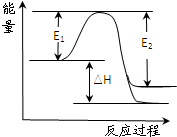
��2����ˮ�ֽ��������������仯����ͼ��ʾ����ʾʹ�ô��������� ���÷�ӦΪ (���Ȼ�������)��Ӧ

��3��1g��������ȫȼ������Һ̬ˮ�ͷų�142.9kJ������д������ȫȼ�յ��Ȼ�ѧ����ʽ�� ��
��4������������CO�ϳɶ����ѵ�������Ӧ���£�
�� 2H2(g) + CO(g)  CH3OH(g)����H ����90.8 kJ��mol��1
CH3OH(g)����H ����90.8 kJ��mol��1
�� 2CH3OH(g)  CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
�� CO(g) + H2O(g)  CO2(g) + H2(g)����H����41.3 kJ��mol��1
CO2(g) + H2(g)����H����41.3 kJ��mol��1
�ܷ�Ӧ��3H2(g)
+ 3CO(g)  CH3OCH3(g) + CO2
(g)�Ħ�H��
CH3OCH3(g) + CO2
(g)�Ħ�H��
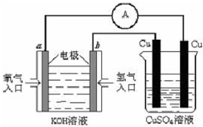
��5������ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������������ȼ�ϵ�ؽ�����ͼ��ʾʵ�飺

������ȼ�ϵ���У������ĵ缫��ӦʽΪ ��
����ͼװ���У�ijһͭ�缫����������3.2g���� a �������ĵ�O2�ڱ�״���µ����Ϊ
L��
��6����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ��ȡ����ȼ�ϵ�ء��������缫����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com