
| A、都容易发生取代反应 |
| B、苯不能被KMnO4氧化 |
| C、苯只能在特殊条件下发生加成反应 |
| D、都能在空气中燃烧 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、同种元素的原子均有相同的质子数和中子数 |
| B、IA族金属元素是同周期中金属性最强的元素 |
| C、ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
| D、2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Fe在过量的Cl2中充分燃烧,转移的电子数为0.3NA |
| B、常温下,22.4L甲烷中含有的共价键数目为4NA |
| C、2mol SO2和1mol O2在密闭容器中催化加热,充分反应后,容器内分子总数为2NA |
| D、由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B、碳酸氢钠溶液中离子浓度的大小关系c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) |
| C、碳酸钠溶液中离子浓度的关系2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) |
| B、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2,三种溶液中水的电离程度:③>①>② |
| C、39g Na2O2与足量水反应后转移的电子数为NA(NA表示阿伏加德罗常数的值) |
| D、当6.9g Fe3O4与足量稀HNO3反应(还原产物只有NO),则参加反应的HNO3为0.28mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、H+、Cl- |
| B、Na+、K+、SO32-、Cl- |
| C、Al3+、K+、Br-、HCO3- |
| D、Fe3+、Na+、H2O2、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
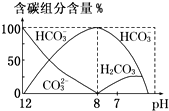 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
c(HC
| ||
c(C
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com