
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C(碳) | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
分析 依据“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”可知碳酸锌与碳在高温下反应生成锌和一氧化碳,据此分析解答.
解答 解:A.碳酸锌与碳在高温下反应生成锌和一氧化碳,为置换反应,故A正确;
B.碳酸锌与碳在高温下反应生成锌和一氧化碳,反应中碳为还原剂,故B正确;
C.碳酸锌与碳在高温下反应生成锌和一氧化碳,方程式::ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑,故C正确;
D.依据题意可知,倭铅是指金属锌,故D错误;
故选:D.
点评 本题考查了金属冶炼的一般原理,把握题干所给信息,熟悉相关物质的性质是解题关键,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:推断题
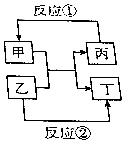 物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:
物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
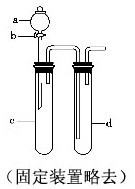 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数为0.3 NA | |
| D. | 1 mol Na2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com