
【题目】如图所示为合成羟甲香豆素中间体的结构简式。下列说法正确的是( )
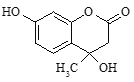
A.该物质分子中所有碳原子可能共平面
B.该物质能在Cu作催化剂条件下氧化生成含醛基的物质
C.1mol该分子最多可与3molNaOH反应
D.与足量溴水反应,1mol该分子最多消耗1molBr2
【答案】C
【解析】
根据题中羟甲香豆素中间体的结构简式可知,本题考查有机化合物的基本结构和反应,运用正四面体上的原子不共面,能在Cu催化下氧化生成醛的醇要求-OH所连C上要有两个H,-COO-、酚羟基均能分别与NaOH反应分析。
A.该物质分子有3个饱和的碳原子,根据甲烷的正四面体结构可知,该有机物分子中所有碳原子不可能共平面,故A错误;
B.能在Cu催化下氧化生成醛的醇,要求-OH所连C上要有两个H,该物质-OH所连C上只有一个H或者无H,因此该物质不能在Cu作催化剂条件下氧化生成含醛基的物质,故B错误;
C. 1mol该分子中含有1mol-COO-、1mol酚羟基均能分别与1molNaOH反应,-COO水解后又生成1mol酚羟基与1molNaOH反应,因此1mol该分子最多可与3molNaOH反应,故C正确;
D. 酚羟基的邻、对位可以与溴水发生取代反应,由于对位被占,因此其与足量溴水反应,1mol该分子至少可以消耗2molBr2,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HX的酸性比HY弱,在物质的量浓度均为0.1molL﹣1的NaX和NaY混合溶液中,下列排序正确的是( )
A. c(OH﹣)>c(HX)>c(HY)>c(H+)
B. c(OH﹣)>c(X﹣)>c(Y﹣)>c(H+)
C. c(OH﹣)>c(Y﹣)>c(X﹣)>c(H+)
D. c(OH﹣)>c(HY)>c(HX)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质
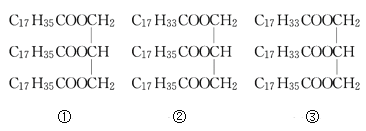
(1)属于简单甘油酯的是(填序号,下同)____,属于混合甘油酯的是______。
(2)①发生皂化反应的化学方程式为________。
Ⅱ.完成银镜反应实验:在AgNO3溶液中逐滴加入氨水,开始时在AgNO3溶液中出现白色沉淀,反应的离子方程式为_____,继续滴入氨水至沉淀溶解,反应的化学方程式为____,边滴边振荡直滴到______为止。再加入乙醛溶液后,水浴加热现象是____,化学方程式为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉;现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如下:

已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32-为8,WO42-为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____________。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:________________________。
(3)滤渣B的主要成分是(写化学式)______。调节pH可选用的试剂是:_____(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C是否洗涤干净的操作是________________________________________。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是_________。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中c(OH-)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂。工业上可用反应:
)可用于照相业作定影剂。工业上可用反应:
![]() 制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
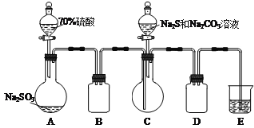
(1)装置A中反应的化学方程式___。
(2)装置B和D的作用是___。
(3)E中的试剂是___。
(4)反应一段时间后,装置C中得到产品是![]() ,其中还含有少量的
,其中还含有少量的![]() 。为测定装置C溶液中
。为测定装置C溶液中![]() 与
与![]() 的物质的量浓度之比,现进行如下实验:
的物质的量浓度之比,现进行如下实验:
步骤Ⅰ:取![]() 装置C烧瓶内的溶液置于锥形瓶中,加入足量的
装置C烧瓶内的溶液置于锥形瓶中,加入足量的![]() 溶液后再加入足量
溶液后再加入足量![]() 溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为
溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为![]() 。
。
步骤Ⅱ:另取![]() 装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用
装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用![]() 碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为
碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为![]() 。该步骤中发生的反应为
。该步骤中发生的反应为![]() ;计算装置C溶液中
;计算装置C溶液中![]() 与
与![]() 的物质的量浓度之比___(写出计算过程)。
的物质的量浓度之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42﹣+10H2O═4Fe(OH)3↓+8OH﹣+3O2↑,测得c(FeO42﹣)在不同条件下变化如图甲、乙、丙、丁所示:
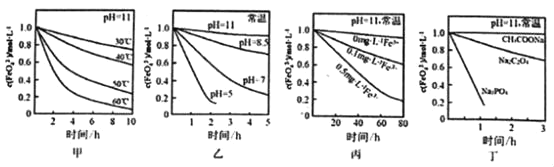
下列说法正确的是( )
A.图甲表明,其他条件相同时,温度越低FeO42﹣转化速率越快
B.图乙表明,其他条件相同时,碱性越强FeO42﹣转化速率越快
C.图丙表明,其他条件相同时,碱性条件下Fe3+能加快FeO42﹣的转化
D.图丁表明,其他条件相同时,钠盐都是FeO42﹣优良的稳定剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
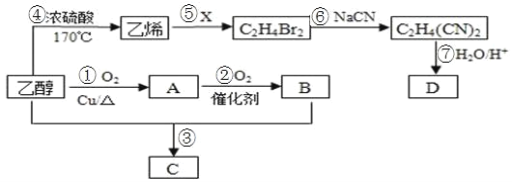
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com