
| N |
| 6.02×1023 |
| N |
| 6.02×1023 |
| m |
| n |
| m |
| M |
| 6.02×1022 |
| 6.02×1023 |
| 3.01×1023 |
| 6.02×1023 |
| 1 |
| 2 |
| 27.75g |
| 0.25mol |
| 116g-m |
| 32g/mol |
| 122g-m |
| 44gmol |
| 122g-100g |
| 44g/mol |
| 124g-100g |
| M |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
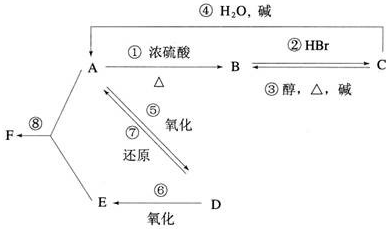
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验变量实验序号 | 银氨溶液 的量/ml | 乙醛的量 /滴 | 水浴温度 /℃ | 反应混合 液的PH | 出现银镜的 时间/min |
| 1 | 2 | 3 | 50 | 11 | T1 |
| 2 | 2 | 3 | 65 | 11 | T2 |
| 3 | 2 | 5 | 65 | 11 | T3 |
| 4 | 2 | 5 | 65 | 4 | 无银镜 |
| 5 | 2 | 5 | 65 | 10 | T4 |
| 6 | 4 | 3 | 50 | 10 | T5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2-Na+ | NaCl | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室配制FeCl2溶液时常加少量HNO3酸化,以防止水解 |
| B、将浓FeCl3溶液逐滴加到煮沸的NaOH溶液可以制得Fe(OH)3胶体 |
| C、烧瓶、锥形瓶、蒸发皿加热时都要垫石棉网 |
| D、用干燥、洁净的玻璃棒蘸取待测液滴在pH试纸(置于表面皿内)上测溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com