
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
科目:高中化学 来源: 题型:多选题
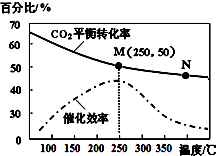 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 氢键也是一种化学键 | D. | 离子化合物中一定含有金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁与足量稀硝酸反应,转移电子的数目为0.2NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4NA | |
| D. | 1L 0.1mol•L-1氯化铜溶液中铜离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
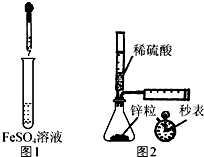
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com