
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是A、若a=b,则c(NH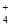 )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH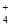 )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
A.③①④②⑤ B.①③⑤④②
C.③②①⑤④ D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期第一学段考试化学试卷(解析版) 题型:填空题
(12分)
碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
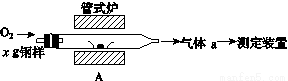
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2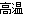 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
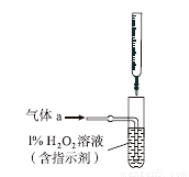
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
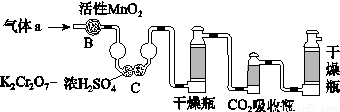
①气体a通过B和C的目的是________________________________________。
②计算钢样中碳的质量分数,应测量的数据是_________________________。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期第一学段考试化学试卷(解析版) 题型:选择题
如图为周期表中短周期的一部分。已知a原子最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是

A.元素a的最高价氧化物对应水化物的酸性比b的弱
B.元素a的原子半径比d的大
C.元素a的单质在空气中燃烧会导致“温室效应”
D.元素a的单质是一种良好的半导体材料
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:实验题
(12分)NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如图:

(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 : 。
(2)加6%的H2O2时,温度不能过高,其目的是 。
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为 。
(4)上述流程中滤液Ⅲ的主要成分是 。
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4?6H2O晶体。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列反应中,反应后固体物质增重的是
A、氢气通过灼热的CuO粉末 B、二氧化碳通过Na2O2粉末
C、铝与Fe2O3发生铝热反应 D、将锌粒投入FeCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A、SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO42-+Fe2++4H+
B、用两个铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C、NO2通入水中:3NO2+H2O===2H++2NO3—+NO
D、过量的CO2通入NaAlO2溶液中:2AlO2—+CO2+3H2O===2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失。下列判断正确的是 ( )
A.一定不含Fe3+和Fe2+
B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C.溶液可能含有NO3-
D.一定含有Fe3+ ,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量25.00mL 溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为 。
(3)通过上述实验事实,该样品的组成为(写化学式) 。
(4)上述实验③KMnO4溶液滴定至终点的现象是)_____________,怎样判断滴定达到了终点 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com