
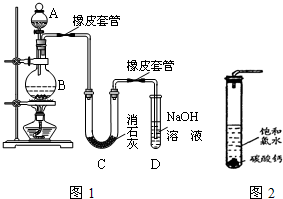
 HCl+HClO 平衡向右移动,HClO浓度增大;
HCl+HClO 平衡向右移动,HClO浓度增大;

科目:高中化学 来源: 题型:
| 实验操作 | 现象 | 解释或结论 | |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡后加入0.5mL有机物Y加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于4 | B、大于4 |
| C、小于4 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质的电离方程式为NaHCO3═Na++H++CO32- |
| B、25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
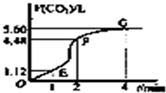 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com