
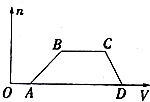
 某混合溶液中可能含有H2SO4、MgCl2、Al2(SO4)3、NH4Cl、NaCl中的几种物质,往该溶液中逐渐加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题:
某混合溶液中可能含有H2SO4、MgCl2、Al2(SO4)3、NH4Cl、NaCl中的几种物质,往该溶液中逐渐加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题:分析 根据图象可知,OA段无沉淀,说明有H2SO4;
AB段有沉淀,CD段沉淀完全消失,说明沉淀为Al(OH)3,无Mg(OH)2↓,说明溶液中只有Al2(SO4)3,无MgCl2;
BC段沉淀不变,说明溶液中含有NH4Cl,此段铵根离子与氢氧根离子反应;
根据分析可知,溶液中一定含有H2SO4、Al2(SO4)3、NH4Cl,一定不含MgCl2,可能含有NaCl,据此进行解答.
解答 解:根据图象可知,OA段无沉淀,说明有H2SO4;
AB段有沉淀,CD段沉淀完全消失,说明沉淀为Al(OH)3,无Mg(OH)2↓,说明溶液中只有Al2(SO4)3,无MgCl2;
BC段沉淀不变,说明溶液中含有NH4Cl,此段铵根离子与氢氧根离子反应;
根据分析可知,溶液中一定含有H2SO4、Al2(SO4)3、NH4Cl,一定不含MgCl2,可能含有NaCl,
(1)溶液中一定含有H2SO4、Al2(SO4)3、NH4Cl,故答案为:H2SO4、Al2(SO4)3、NH4Cl;
(2)溶液中一定不含MgCl2,故答案为:MgCl2;
(3)溶液中可能存在的物质为NaCl,用焰色反应可以判断是否含有该物质,现象是火焰呈黄色,故答案为:NaCl;火焰呈黄色;
(4)①AB段铝离子与氢氧根离子反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,
故答案为:Al3++3OH-=Al(OH)3↓;
②CD段为氢氧化铝沉淀与氢氧根离子反应生成偏铝酸根和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了未知物的推断,题目难度中等,明确图象中曲线变化的含义为解答关键,试题侧重考查学生的分析、理解能力,注意掌握常见物质的性质及检验方法,明确铝离子与氢氧根离子反应的现象,为解答该题的突破口.


科目:高中化学 来源: 题型:选择题
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
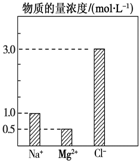 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 既含有羟基又含有醛基的有3种 | |
| D. | 存在分子中含有六元环的同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ; F的化学式FeCl2.
; F的化学式FeCl2. .反应②:
.反应②: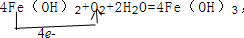 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
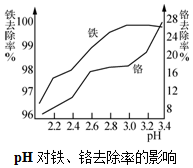 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com